
下列有關熱化學方程式的敘述中,正確的是
| A.含20.0g NaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則表示該反應中和熱的熱化學方程式為NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(1) ΔH=+57.4kJ/mo1 |
| B.已知C(石墨,s)=C(金剛石,s) ΔH>0,則石墨比金剛石穩定 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH =—483.6kJ/mol,則H2燃燒熱為241.8kJ/mol |
| D.己知2C(s)+2O2(g)=2CO2(g) ΔH 1;2C(s)+O2(g)="2CO(g)" ΔH 2;則ΔH 1<ΔH 2 |
 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案科目:高中化學 來源: 題型:單選題
下列說法或表示方法中,正確的是
| A.等質量的硫蒸氣和硫黃分別完全燃燒,前者放出的熱量多 |
| B.a ℃、b kPa下,將0.5 mol O2和1.5 mol H2置于密閉容器中充分反應生成H2O(g),放熱c kJ,其熱化學方程式為2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1 |
| C.常溫常壓下,2.8 g CO氣體完全燃燒放出的熱量為28.26 kJ,則表示CO燃燒熱的熱化學方程式為2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1 |
| D.稀硫酸溶液與稀NaOH溶液反應的中和熱為57.3 kJ·mol-1,則稀醋酸溶液與稀NaOH溶液反應的熱化學方程式可表示為CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列與化學反應能量變化相關的敘述,正確的是( )
| A.反應熱就是反應放出的熱量 |
| B.放熱反應的反應速率總是大于吸熱反應的反應速率 |
| C.化學反應中的焓變僅含化學鍵斷裂和形成的能量變化 |
| D.同溫同壓下,H2(g)+Cl2(g)=2HCl(g) △H,在光照和點燃條件下反應,△H相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
| A.CO能繼續和氧氣反應生成穩定的CO2,所以CO的燃燒反應一定是吸熱反應 |
| B.1 mol硫酸與1 mol Ba(OH)2完全中和所放出的熱量為中和熱 |
| C.相同條件下,2mol氫原子所具有的能量大于1mol氫分子所具有的能量 |
| D.101 kPa時,1 mol碳燃燒所放出的熱量為碳的燃燒熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
氫化熱是指一定條件下,1 mol 不飽和化合物加氫時放出的熱量。表中是環己烯( )、環己二烯(
)、環己二烯( )和苯的氫化熱數據。
)和苯的氫化熱數據。
| 化合物 | 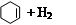  | 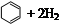  | 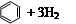  |
| 氫化熱 (kJ/mol) | 119.7 | 232.7 | 208.4 |
 轉變為
轉變為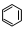 時放熱
時放熱查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知N2(g)+3H2(g) 2NH3(g) △H=— 92.4kJ?mo1—1,下列結論正確的是
2NH3(g) △H=— 92.4kJ?mo1—1,下列結論正確的是
| A.在密閉容器中加入1mol N2和3mol H2充分反應放熱92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ?mo1—1,則Q>92.4 2NH3(l)△H=— QkJ?mo1—1,則Q>92.4 |
| C.增大壓強,平衡向右移動,平衡常數增大 |
| D.若一定條件下反應達到平衡,N2的轉化率為20%,則H2的轉化率一定為60% |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列各表述與示意圖一致的是
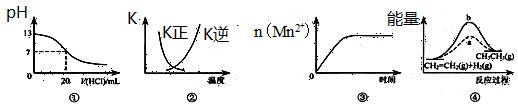
| A.圖①表示25℃時,用0.1 mol·L-1鹽酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH隨加入酸體積的變化 |
B.圖②中曲線表示反應2SO2(g) + O2(g) 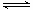 2SO3(g);ΔH<0 正、逆反應的平衡常數K隨溫度的變化 2SO3(g);ΔH<0 正、逆反應的平衡常數K隨溫度的變化 |
| C.圖③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液與過量的0.1 mol·L-1 H2C2O4溶液混合時,n(Mn2+) 隨時間的變化 |
| D.圖④中a、b曲線分別表示反應CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化劑時,反應過程中的能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列各表述與示意圖一致的是
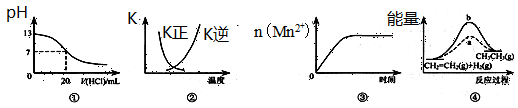
| A.圖①表示25℃時,用0.1 mol·L-1鹽酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH隨加入酸體積的變化 |
B.圖②中曲線表示反應2SO2(g) + O2(g)  2SO3(g);ΔH<0 正、逆反應的平衡常數K隨溫度的變化 2SO3(g);ΔH<0 正、逆反應的平衡常數K隨溫度的變化 |
| C.圖③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液與過量的0.1 mol·L-1 H2C2O4溶液混合時,n(Mn2+) 隨時間的變化 |
| D.圖④中a、b曲線分別表示反應CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化劑時,反應過程中的能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,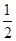 H2SO4(濃,aq)+NaOH(aq)=
H2SO4(濃,aq)+NaOH(aq)=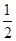 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列說法正確的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列說法正確的是 ( )。
| A.上述熱化學方程式中的化學計量數表示分子個數 |
| B.ΔH1>ΔH2 |
| C.ΔH2=-57.3 kJ·mol-1 |
| D.|ΔH1|>|ΔH2| |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com