
【題目】核反應不僅能發電也能制造元素。2016 年初國際上確認,利用原子核間的撞擊已制造出原子序數分別為113、115、117 和118 四種新元素,填補了目前元素周期表的空白,其中113 號元素與Al 元素處于同一主族。下列說法正確的是
A.核反應發電實現了化學能到電能的轉化
B.115 號元素一定是處于VA 族的非金屬元素
C.117 號元素與F、Cl、Br、I均處于VIIA族
D.四種新元素位于元素周期表中的不同周期
科目:高中化學 來源: 題型:
【題目】土法釀造葡萄酒(只加糖的純天然釀酒法)容易出問題,有報道說,喝了自制葡萄酒差點失明。主要原因是發酵過程產生的菌種多達百種,難以控制,而產生對神經有毒的甲醇等物質。科學釀酒加SO2等輔料。我國國家標準(GB2760-2014)規定葡萄酒中SO2的殘留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.氧化細菌 B.抗氧化 C.漂白 D.增酸作用
I.實驗方案一
利用SO2的漂白性檢測干白葡萄酒(液體為無色)中的SO2或HSO3。設計如圖1的實驗:
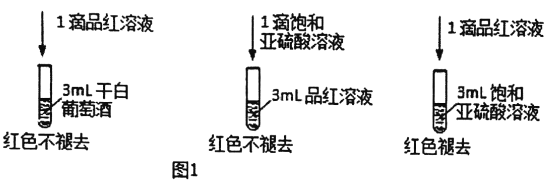
(2)甲同學得出實驗結論: 干白葡萄酒中不含SO2或HSO3。這個結論是否合理?說明理由_________。
Ⅱ.實驗方案二
如圖2是在實驗室進行二氧化硫制備與性質實驗的組合裝置,部分固定裝置未畫出。

(3)關閉彈簧夾2,打開彈簧夾1,注入硫酸至浸沒瓶中固體,寫出C裝置反應的方程式______,每消耗1molNa2O2,則轉移電子數___________。
(4)關閉彈簧夾1后,打開彈簧夾2,殘余氣體進入E、F中,為了證明SO2有還原性,并從綠色化學的角度考慮,則Z試劑可以是___________,現象是___________。
Ⅲ.實驗方案三
用電化學法模擬工業處理SO2。將硫酸工業尾氣中的SO2通入圖3 裝置(電極均為惰性材料) 進行實驗,可用于制備硫酸,同時獲得電能:

(5)M極發生的電極反應式為__________。N極區溶液pH______(變大、變小、不變)。
(6)若使該裝置的電流強度達到2.0A,理論上8 分鐘應向負極通入標準狀況下氣體的體積為___L (已知: 1個e所帶電量為1.6×10-19C,阿伏伽德羅常數6×1023)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】具有明顯現象的官能團特征反應常被用來鑒定化合物. ①欲區分CH3CH2OH和CH3CHO,應選用(填字母).
a.蒸餾水 b.銀氨溶液 c.鹽酸
②欲區分 ![]() 和
和 ![]() ,應選用 (填字母).
,應選用 (填字母).
a.KMnO4溶液 b.溴水 c.Na2CO3溶液
③欲區分 ![]() 和
和 ![]() ,應選用 (填字母).
,應選用 (填字母).
a.AgNO3溶液 b.NaOH溶液 c.FeCl3溶液.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有三種有機物的分子式均為C8H8,其鍵線式分別為,X: ![]() ,Y:
,Y: ![]() ,Z:
,Z: ![]() .下列說法正確的是
.下列說法正確的是
A. X 能使酸性高錳酸鉀溶液褪色,也能使溴的四氯化碳溶液褪色
B. Y 能發生取代反應、加成反應和氧化反應
C. X、Y、Z互為同分異構體,它們二氯代物的同分異構體數目相同
D. X、Y、Z分子中所有原子一定在同一平面內
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加酶洗衣粉在溫水中比在冷水中洗滌效果更佳的主要原因是 ( )
A.酶具有專一性 B.酶的活性受pH影響
C.酶具有高效性 D.酶的活性受溫度影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某種食品的配料標簽如圖所示: 
①其中,富含蛋白質的物質是 , 富含油脂的物質是 , 有防腐作用的是 .
②用于包裝該食品的聚乙烯塑料包裝屬于(填字母).
A.有機高分子材料 B.無機非金屬材料 C.金屬材料
③大量使用塑料包裝,會造成“污染”,這種包裝袋屬于(可回收資源/不可回收資源).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化二硫(S2Cl2)是一種重要的化工原料,常用作橡膠硫化劑,改變生橡膠受熱發粘、遇冷變硬的性質。查閱資料可知S2Cl2具有下列性質:
物理性質 | 毒性 | 色態 | 揮發性 | 熔點 | 沸點 |
劇毒 | 金黃色液體 | 易揮發 | -76℃ | 138℃ | |
化學性質 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高熱或與明火接觸,有引起燃燒的危險 ④受熱或遇水分解放熱,放出腐蝕性煙氣 | ||||
(1)制取少量S2Cl2
實驗室可利用硫與少量氯氣在110~140℃反應制得S2Cl2粗品,氯氣過量則會生成SCl2。

①儀器m 的名稱為__________,裝置F 中試劑的作用是_________。
②裝置連接順序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③實驗前打開K1,通入一段時間的氮氣排盡裝置內空氣。實驗結束停止加熱后,再通入一段時間的氮氣,其目的是_____________。
④為了提高S2Cl2的純度,實驗的關鍵是控制好溫度和____________。
(2)少量S2Cl2泄漏時應噴水霧減慢其揮發(或擴散),并產生酸性懸濁液,但不要對泄漏物或泄漏點直接噴水,其原因是______________。
(3)S2Cl2遇水會生成SO2、HCl兩種氣體,某同學設計了如下實驗方案來測定該混合氣體中SO2的體積分數。

①W溶液可以是_____(填標號)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②該混合氣體中二氧化硫的體積分數為_________(用含V、m 的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應: 2SO3(g) ![]() 2SO2(g)+O2(g) △H>0,某溫度 下,將2molSO3置于10L密閉容器中,反應達平衡后,SO3的平衡轉化率(a)與體系總壓強(p)的關系如圖甲所示。則下列說法正確的是
2SO2(g)+O2(g) △H>0,某溫度 下,將2molSO3置于10L密閉容器中,反應達平衡后,SO3的平衡轉化率(a)與體系總壓強(p)的關系如圖甲所示。則下列說法正確的是

①由圖甲推斷,B點SO2的平衡濃度為03mol/L
②由圖甲推斷,A點對應溫度下的平衡常數為1.25×10-3
③達平衡后,壓縮容器容積,則反應速率變化圖像可以用圖乙表示
④相同壓強、不同溫度下SO3的轉化率與溫度關系如丙圖所示
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com