
【題目】下列有關氧化還原反應的說法錯誤的是( )
A. 氧化劑得電子,還原劑失電子
B. 某元素從化合態到游離態,可能被氧化也可能被還原
C. 難失去電子的原子,不一定易得電子
D. 一種元素被氧化,一定有另一種元素被還原
科目:高中化學 來源: 題型:
【題目】高錳酸鉀可用于生活消毒,是中學化學常見的氧化劑。工業上,用軟錳礦( 主要成分MnO2)制高錳酸鉀的流程如下(部分條件和產物省略):
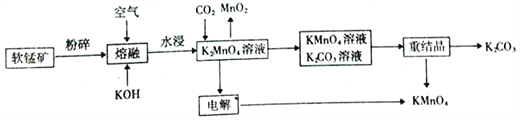
請回答下列問題:
(1)在“水浸”過程中,提高K2MnO4浸出率(浸出的K2MnO4質量與“熔塊”質量之比)的措施有_______( 至少寫出兩點)。
(2)“熔融”過程中發生反應的化學方程式為___________。
(3)CO2 與K2MnO4反應的離子方程式為___________。
(4)“電解”過程中使用的是惰性電極,則:
①陽極反應的方程式為__________。
②陰極附近溶液的pH將__________。(填“增大”“減小” 或“ 不變”)。
(5)在上述過程中產生的Mn2+會對環境造成污染。工業上,通過調節pH使廢水中的Mn2+形成Mn(OH)2 沉淀。當pH=10時,溶液中的c(Mn2+)=______(已知:Ksp[Mn(OH)2]=2.0×10-13。相關數據均在常溫下測定)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上消除氮氧化物的污染,可用如下反應:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在溫度T1和T2時,分別將0.50mol CH4和1.2mol NO2充入體積為1L的密閉容器中,測得n(CH4)隨時間變化數據如下表:下列說法不正確的是( )
溫度 | 時間/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min內,T1時CH4的化學反應速率比T2時小
B.溫度:T1<T2
C.a<0
D.平衡常數:K(T1)<K(T2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅及其化合物在工農業生產及日常生活中應用非常廣泛.
(1)由輝銅礦制取銅的反應過程為:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 ,
請寫出Cu2S與O2反應生成Cu與SO2的熱反應方程式: .
(2)氯化銅溶液中銅各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與c(Cl﹣) 的關系如圖1.①當c(Cl﹣)=9molL﹣1時,溶液中主要的3種含銅物種濃度大小關系為 . 
②在c(Cl﹣)=1molL﹣1的氯化銅溶液中,滴入AgNO3溶液,含銅物種間轉化的離子方程式為(任寫一個).
(3)電解Na2HPO3溶液可得到亞磷酸,裝置如圖2
(說明:陽膜只允許陽離子通過,陰膜只允許陰離子通過)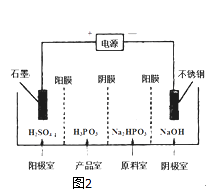
①陽極的電極反應式為: .
②產品室中反應的離子方程式為: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】單質鈦(Ti)的機械強度高,抗腐蝕能力強,有“未來金屬”之稱。以TiO2制金屬鈦,主要反應有:
①TiO2+2C+2Cl2 ![]() TiCl4+2CO; ②TiCl4+2Mg
TiCl4+2CO; ②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列敘述不正確的是
A. 反應①中TiO2是氧化劑 B. 反應②表現了金屬鎂還原性比金屬鈦強
C. 反應①中碳是還原劑 D. 反應①中氧化劑與還原劑物質的量之比為1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘具有多種放射性同位素. ![]() I俗稱“碘131”,廣泛地用于醫學診斷作為追蹤劑和甲狀腺內分泌失調癥的治療.下列有關
I俗稱“碘131”,廣泛地用于醫學診斷作為追蹤劑和甲狀腺內分泌失調癥的治療.下列有關 ![]() I敘述正確的是( )
I敘述正確的是( )
A.碘元素的相對原子質量為131
B.![]() I是一種新發現的碘的核素
I是一種新發現的碘的核素
C.![]() I位于元素周期表中第4周期ⅦA族
I位于元素周期表中第4周期ⅦA族
D.![]() I核內的中子數與核外電子數之差為29
I核內的中子數與核外電子數之差為29
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空:
(1)下列實驗操作或對實驗事實的描述中,正確的是(填序號)
①為測定熔融氫氧化鈉的導電性,可將氫氧化鈉固體放在石英坩堝中加熱熔化
②化學藥品著火,都要立即用水或泡沫滅火器滅火
③配制一定物質的量濃度的稀硫酸溶液時,量取濃硫酸后的量筒要用蒸餾水洗滌,并把洗滌液轉入容量瓶中
④配制一定物質的量濃度的溶液在定容時,俯視容量瓶的刻線,會使配制的濃度偏高
⑤檢驗紅磚中的紅色物質是否是Fe2O3的操作步驟為:樣品→粉碎→加水溶解→過濾→向濾液中滴加KSCN溶液
(2)將下列物質進行分類:
①11H 與13H ②O2與O3 ③乙醇與甲醚(CH3﹣O﹣CH3)④ 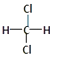 與
與 
⑤CH3CH2CH2CH3與CH3﹣CH(CH3)﹣CH3⑥C60與金剛石 ⑦乙醇與甘油
互為同位素的是(填編號,下同);互為同素異形體的是互為同分異構體的是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫、鐵的化合物有廣泛的應用。
(1)過二硫酸銨(NH4)2S2O8可以看成雙氧水的衍生物,H2O2分子中的兩個H原子被—SO3H基取代后即為過二硫酸。
①(NH4)2S2O8中硫元素的化合價為_________;
②用過二硫酸銨溶液檢測廢水中的Mn2+,配平下面的離子反應:_____S2O82-+____Mn2++_____=____MnO4-+____SO42-+____。
(2)大蘇打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯氣。若1 mol Na2S2O3完全反應,失去8mol電子。寫出其水溶液吸收氯氣的離子方程式______________。
(3)磁性材料A是由兩種元素組成的化合物,某研究小組按如圖所示流程探究其組成:
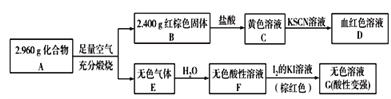
①已知化合物A能與鹽酸反應,生成一種淡黃色不溶物和一種氣體(標準狀況下密度為1.518g/L),寫出該反應的化學方程式:_______________________。
②已知25 ℃時,Ksp[Fe(OH)3]=8×10-39,該溫度下反應Fe(OH)3+3H+![]() Fe3++3H2O的平衡常數為_________(列式并計算)。向0.001 mol/L FeCl3溶液中通入氨氣(體積變化忽略不計),開始沉淀時溶液的pH為________。(lg 5=0.7)
Fe3++3H2O的平衡常數為_________(列式并計算)。向0.001 mol/L FeCl3溶液中通入氨氣(體積變化忽略不計),開始沉淀時溶液的pH為________。(lg 5=0.7)
(4)①FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料,該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+FeS2![]() Fe+2Li2S,正極反應式是____。
Fe+2Li2S,正極反應式是____。
②FeSO4可轉化為FeCO3,FeCO3在空氣中加熱會發生反應,可制得鐵系氧化物材料。已知25 ℃、101 kPa時:4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)
2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是_______。
2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com