
【題目】下圖是某廠生產的某種加鈣食鹽包裝標簽上的部分文字,請閱讀后回答以下問題:

(1)標簽上鈣含量中,鈣是指 ;(填元素、單質、化合物、其他)
(2)為了檢驗此鹽中是否含有CaCO3,在家庭廚房里可選用的物質是 ;
(3)為了測定此鹽的鈣元素含量,取10克此鹽溶于水,加入足量鹽酸,生成標準狀況下二氧化碳 67.2亳升。請計算此加鈣食鹽中鈣元素的質量分數。(列出計算過程)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】(1)一個12C原子質量為ag, 有一種X原子的質量為bg.設NA為阿伏伽德羅常數,則X的相對原子質量可表示為:
(2)現有下列物質:①氫氧化鉀固體 ②稀硫酸 ③銅片 ④蔗糖 (C12H22O11) 固體 ⑤熔融的氯化鈉。
用以上物質的序號填空:屬于電解質的是_______________,屬于非電解質的是____________;所給狀態下能夠導電的是______________。
(3)反應(未配平):BrF3+H2O-Br2+O2+HBrO3+HF已知生成物中Br2與O2的物質的量之比為1:1。則:
①配平后H2O 與HF物質的量之比為 ;
②還原劑為 ;
③如有5molH2O參加反應則參加氧化還原反應的H2O物質的量為 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應mA(s)+nB(g)eC(g)+fD(g),反應過程中, 當其它條件不變時,C的百分含量(C%)與溫度(T)和壓強(P)的關系如圖,下列敘述正確的是( )

A.達到平衡后,加入催化劑則C%增大
B.達到平衡后,若升溫,平衡左移
C.化學方程式中n<e+f
D.達到平衡后,增加A的量有利于平衡向右移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下, CH4與 H2O(g)發生反應: CH4(g) + H2O(g)=CO(g) + 3H2(g)。設起始n(H2O)/n(CH4)=Z,在恒壓下,平衡時 CH4的體積分數 φ(CH4)與Z和 T(溫度)的關系如右圖所示,下列說法正確的是

A.該反應的焓變△H>0
B.圖中 Z 的大小為 a>3>b
C.圖中 X 點對應的平衡混合物中 n(H2O)/n(CH4)=3
D.溫度不變時,圖中 X點對應的平衡在加壓后 φ(CH4)減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在2 L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如下圖所示:

下列描述正確的是( )
A.反應開始到10 s,用Z表示的反應速率為0.158 mol·(L·s)-1
B.反應開始到10 s,X的物質的量濃度減少了0.79 mol·L-1
C.反應開始到10 s時,Y的轉化率為79.0%
D.反應的化學方程式為X(g)+Y(g)====Z(g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯元素的單質及其化合物在生產生活中應用極其廣泛。請完成下列填空:
Ⅰ:氯氣性質探究
設計下圖實驗裝置來制備并驗證氯氣的性質(部分夾持裝置未畫出)。

(1)A中放置固體二氧化錳的裝置名稱是___________________。
(2)裝置B的作用是___________________。
(3)硬質玻璃管C中事先裝有兩個沾有相關試劑的棉球,左側棉球的實驗現象為 。
(4)D中的NaOH溶液用來吸收尾氣,向反應后的D中加入足量稀硫酸會產生氣體,寫出該反應的離子方程式 。
Ⅱ:制備HClO
(5)設計裝置E代替上圖的裝置C,用于制備較高濃度的HClO溶液。在圓底燒瓶底部,有一用塑料網包住的過量塊狀碳酸鈣。

①該方案可以制得較高濃度HClO的原因是(結合必要的化學語言回答) 。
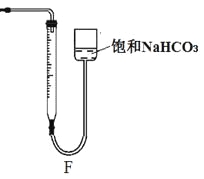
②反應結束后將塑料網中剩余的石灰石提出液面,所得的溶液與稀鹽酸混合,立即產生大量CO2氣體,則反應所得溶液中的溶質除HClO外,還含有 、 (寫兩種鈣鹽的化學式,一種正鹽,一種酸式鹽);該小組同學測得反應中碳酸鈣質量減少M g,反應后從所得的200mL溶液中取用10mL與足量稀鹽酸混合,連接F裝置測得產生的氣體體積為V L(已換算成標準狀況),則原溶液中含鈣正鹽的濃度為 mol·L-1(用含M、V的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生兩個平行反應,分別生成CH3OH和CO,反應的熱化學方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 反應Ⅰ
CH3OH(g)+H2O(g)△H1 反應Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-1 反應Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-1 反應Ⅱ
某實驗室控制CO2和H2初始投料比為1:2.2,在相同壓強下,經過相同反應時間測得如下實驗數據:
T(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[備注]Cat.1:Cu/ZnO納米棒;Cat.2:Cu/ZnO納米片;甲醇選擇性:轉化的CO2中生成甲醇的百分比
(1)研究證實,CO2可在酸性水溶液中通過電解生成甲醇,則生成甲醇的電極反應式是_________________。
(2)從表中實驗數據可以分析出,提高CO2轉化成CH3OH的選擇性的方法有______________。
(3)能說明反應Ⅱ已經達到平衡狀態的是_____________。
A.混合氣體的平均相對分子質量不變
B.混合氣體的密度不變
C.v(H2)正>v(CO)正
D.n(CO)/n(H2)不變
(4)在恒容密閉容器中,由CO2和H2進行反應I合成甲醇,在其它條件不變的情況下,探究溫度對化學平衡的影響,實驗結果如圖。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡轉化率的措施有___________(填標號)。
A.降低反應溫度
B.投料比不變,增加反應物的濃度
C.增大CO2和H2的初始投料比
D.混合氣體中摻入一定量惰性氣體(不參與反應span>)
(5)在T1溫度時,將1.00molCO2和3.00molH2充入體積為1.00L的恒容密閉容器中,容器起始壓強為P0,僅進行反應I。
①充分反應達到平衡后,若CO2轉化率為a,則容器內的壓強與起始壓強之比為________(用a表示)。
②若經過3h反應達到平衡,平衡后,混合氣體物質的量為3.00mol,則該過程中H2的平均反應速率為____________(保留三位有效數字);平衡常數K可用反應體系中氣體物質分壓表示,即K表達式中用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數。則上述反應壓力平衡常數KP為____________(用P0表示,并化簡)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com