
【題目】某氯化鐵樣品含有FeCl2雜質。現要測定其中鐵元素的質量分數,實驗按以下步驟進行:
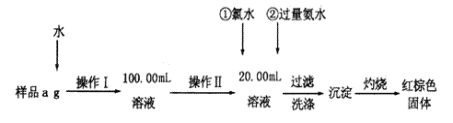
(1)操作I所用到的玻璃儀器除燒杯、量筒、100mL的容量瓶外,還必須有_________(填儀器名稱)。容量瓶使用前必須進行的操作是_________(填序號)
A.干燥 B.驗漏 C.潤濕
(2)寫出加入氯水發生反應的離子方程式_______________________________________。該反應若不用氯水,可用下列試劑中的______________代替(填序號)。
A.H2O2 B.碘水 C.NaClO
(3)檢驗沉淀已經洗滌干凈的操作及現象是__________________________。
(4)坩堝質量為W1g,加熱后坩堝與紅棕色固體總質量為W2g,則樣品中鐵元素的質量分數是____________________(列出原始算式,不需化簡)
【答案】玻璃棒、膠頭滴管 B 2Fe 2++Cl2=2Fe3++2Cl- AC 取最后一次洗滌液于試管,滴加少量硝酸酸化,再加入硝酸銀溶液,若無白色沉淀生成,則證明已經洗滌干凈 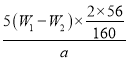 ×100%
×100%
【解析】
本實驗目的是測定鐵的質量分數,采取的方法是使樣品溶解、反應、最終生成氧化鐵,然后通過氧化鐵質量來求鐵的質量分數。
(1)由圖可知,操作I是將加水溶解后的溶液稀釋成100.00mL溶液,需要燒杯溶解,用玻璃棒攪拌,引流等,定容需要膠頭滴管;容量瓶使用前需要檢漏;
(2)加氯水就是讓+2價鐵變為+3價;不用氯水可以用過氧化氫、次氯酸鈉代替做氧化劑,碘水中碘單質不能氧化亞鐵離子;
(3)溶液中存在氯化銨,可用硝酸和硝酸銀溶液檢驗最后一次洗滌液中是否存在氯離子,以判斷沉淀是否洗凈;
(4)加熱分解所得的物質是Fe2O3,其質量為(W2-W1)g,由于使用20.00mL溶液進行實驗,因此100.00mL溶液可以得到Fe2O3質量為5(W2-W1)g,根據化學式計算鐵元素的質量,再利用質量分數的定義計算原氯化鐵樣品中鐵元素的質量分數。
(1)由圖可知,操作I是將加水溶解后的溶液稀釋成100.00mL溶液,玻璃儀器除量筒、100mL的容量瓶外,還必須有溶解的燒杯和玻璃棒,容量瓶定容至離刻度線1~2cm時需要用膠頭滴管定容;所以缺少的儀器是玻璃棒和膠頭滴管;容量瓶使用前必須進行的操作是檢查受否漏水,因此合理選項是B;
(2)加氯水就是使+2價Fe2+氧化為變為+3價Fe3+,該反應的離子方程式為:2Fe 2++Cl2=2Fe3++2Cl-,若不用氯水可以用過氧化氫、次氯酸鈉代替氯氣作氧化劑,碘水中碘單質不能氧化亞鐵離子,因此合理選項是AC;
(3)Fe(OH)3沉淀是從NH4Cl溶液中過濾出來的,Fe(OH)3沉淀上吸附有氯化銨,可用硝酸和硝酸銀溶液檢驗最后一次洗滌液中是否存在氯離子,檢驗方法是:取最后一次洗滌液于試管中,滴加稀硝酸酸化,再加入少量硝酸銀溶液,若無白色沉淀生成,則證明已洗滌干凈;
(4)因鐵元素質量守恒,即紅棕色固體中的鐵就是樣品中鐵,Fe2O3的質量為W2-W1g,由于參加反應的溶液只取所配溶液的![]() ,因此鐵元素的質量為5(W2-W1)g×
,因此鐵元素的質量為5(W2-W1)g×![]() ,則樣品中鐵元素的質量分數是
,則樣品中鐵元素的質量分數是 ×100%。
×100%。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】藥物F具有抗腫瘤、降血糖、降血壓等多種生物活性,其合成路線如下:

已知:M的結構簡式為: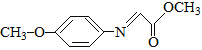 。
。
請回答下列問題:
(1)A的化學名稱是_______________,B的化學式是________________。
(2)C中官能團的名稱是__________________________。
(3)寫出F的結構簡式__________________________。
(4)已知A在一定條件下能生成可降解的聚酯,請寫出該反應化學方程式:______________________________。
(5)滿足下列條件的M的同分異構體有_______種(不含立體異構)。
① 能夠發生銀鏡反應。
② 含有硝基(–NO2),且硝基直接連在苯環上。
③ 含有苯環且苯環上只有兩個取代基。
其中核磁共振氫譜為四組峰且峰面積之比為6∶2∶2∶1的結構簡式為________(寫出一種即可)。
(6)寫出用乙醛為原料制備高分子化合物聚丙烯腈的合成路線(無機試劑任選):______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g)。反應過程和能量關系如圖所示(圖中的△H表示生成1mol產物的數據)。
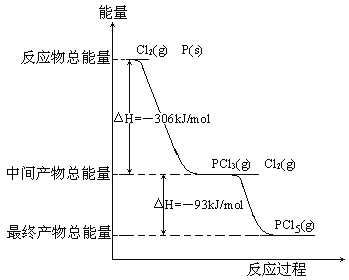
根據上圖回答下列問題:
(1)P和Cl2反應生成PCl3的熱化學方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的熱化學方程式_________________________________,上述分解反應是一個可逆反應,溫度T1時,在密閉容器中加入0.80molPCl5,反應達到平衡時PCl5還剩0.60mol,其分解率α1等于_________;若反應溫度由T1升高到T2,平衡時PCl5的分解率為α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工業上制備PCl5通常分兩步進行,先將P和Cl2反應生成中間產物PCl3,然后降溫,再和Cl2反應生成PCl5。原因是________________________________________。
(4)P和Cl2分兩步反應生成1molPCl5的△H3=_________,P和Cl2一步反應生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5與足量水充分反應,最終生成兩種酸,其化學方程式是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酰氯(SO2Cl2)和亞硫酰氯(SOCl2)常用作氯化劑,都可用于醫藥、農藥、染料工業及有機合成工業。亞硫酰氯還用于制鋰亞硫酰氯(Li/SOCl2)電池。
有關物質的部分性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 其它性質 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,產生大量白霧 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且難分解 |
實驗室用干燥而純凈的二氧化硫和氯氣合成硫酰氯,反應的熱化學方程式為:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反應裝置如圖所示(夾持儀器已省略),請回答有關問題:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反應裝置如圖所示(夾持儀器已省略),請回答有關問題:

(1)儀器A的名稱為___________;
(2)儀器B的作用是_____________________;
(3)裝置丙中盛放的試劑為____________,在實驗室用氫氧化鈉吸收多余硫酰氯反應的離子方程式為___________________;
(4)為提高本實驗中硫酰氯的產率,在實驗操作中需要注意的事項有_________(填序號)
①先通冷凝水,再通氣體 ②控制氣流速率,宜慢不宜快
③若三頸燒瓶發燙,可適當降溫 ④加熱三頸燒瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解獲得,該反應的化學方程式為:2ClSO3H=H2SO4+SO2Cl2,此方法得到的產品中會混有硫酸。
①從分解產物中分離出硫酰氯的實驗操作名稱為__________________,
②設計實驗方案檢驗氯磺酸分解制取硫酰氯產品中混有硫酸,下列方案合理的是:_____(填字母)
A.取樣品溶于水,滴加紫色石蕊溶液變紅:再取少量溶液,加入BaCl2溶液產生白色沉淀,說明含有H2SO4。
B.取樣品在干燥條件下加熱至完全反應,冷卻后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液變紅,說明含有H2SO4。
(6)Li—SOCl2電池可用于心臟起搏器。該電池的電極材料分別為鋰和碳,電解質溶液是LiAlCl4—SOCl2。電池的總反應可表示為:4Li+2SOCl2===4LiCl+S+SO2。
①寫出該電池正極發生的電極反應式_______________________________
②組裝該電池必須在無水、無氧的條件下進行,原因是__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉晶體(Na2S2O3·5H2O)又稱海波,呈無色透明狀,易溶于水,不溶于乙醇,常用作棉織物漂白后的脫氯劑、定量分析中的還原劑。
Ⅰ. Na2S2O3·5H2O的制備
Na2S2O3·5H2O的制備方法有多種,其中亞硫酸鈉法是工業和實驗室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制備過程如下:
①稱取12.6g Na2SO3于100mL燒杯中,加50 mL去離子水攪拌溶解。
②另取4.0 g硫粉于200mL燒杯中,加6 mL乙醇充分攪拌均勻將其潤濕,再加入Na2SO3溶液,隔石棉小火加熱煮沸,不斷攪拌至硫粉幾乎全部反應。
③停止加熱,待溶液稍冷卻后加2 g活性炭,加熱煮沸2分鐘(脫色)。
④趁熱過濾,得濾液至蒸發皿中, ______________、____________________。
⑤過濾、洗滌,用濾紙吸干后,稱重,計算產率。
(1)加入的硫粉用乙醇潤濕的目的是____________________________。
(2)步驟④趁熱過濾的原因_____________________,空格處應采取的操作是_________________、____________________。
(3)步驟⑤洗滌過程中,為防止有部分產品損失,應選用的試劑為___________。
(4)濾液中除Na2S2O3和未反應完全的Na2SO3外,最可能存在的無機雜質是________________,生成該雜質的原因可能是____________________________。
Ⅱ.產品純度的測定
準確稱取1.00 g產品(硫代硫酸鈉晶體的摩爾質量為248 g/mol),用適量蒸餾水溶解,以淀粉作指示劑,用0.1000 mol/L碘標準溶液滴定至終點,消耗21.00 mL。反應的離子方程式為:2S2O32-+I2=S4O62-+2I-。
(5)計算所得產品的純度為___________(保留三位有效數字),該數據的合理解釋可能是__________(不考慮實驗操作引起的誤差)。
Ⅲ.產品的應用
(6)Na2S2O3常用于脫氯劑,在溶液中易被Cl2氧化為SO42-,該反應的離子方程式為 ____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫正確的是
A. 食醋除去瓶膽內的水垢:CaCO3+2H+===Ca2++CO2↑+H2O
B. 漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
C. Al溶于NaOH溶液:2Al+2OH-+2H2O===2 AlO+3H2↑
D. 用惰性電極電解硫酸銅溶液:2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以高硫鋁土礦(主要成分為Al2O3、Fe2O3、SiO2,少量FeS2)為原料,生產Fe3O4的部分工藝流程如下:

下列說法錯誤的是
A. 用NaOH溶液吸收焙燒過程產生的SO2有利于保護環境和資源再利用
B. 從高硫鋁土礦中可制得Al、Fe的化合物
C. 向“過濾”得到的濾液中通入過量CO2,鋁元素存在的形式由AlO轉化為Al3+
D. FeS2與Fe2O3混合后在無氧條件下焙燒的目的是生成Fe3O4和SO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子核磁共振譜(NMR)是研究有機化合物結構的有力手段之一。在所研究化合物的分子中,每一結構中的等性氫原子,在NMR譜中都給出相應的峰(信號)。譜中峰的強度與結構中的H原子數成正比。例如,乙醛的結構式為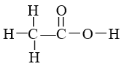 ,其NMR譜中有兩個信號,其強度之比為3∶1。
,其NMR譜中有兩個信號,其強度之比為3∶1。
(1)分子式為C3H6O2的二元混合物,如果在NMR譜中觀察氫原子給出的峰有兩種情況:第一種情況峰的強度比為3∶3;第二種情況峰的強度比為3∶2∶1。由此可推斷該混合物的組成可能是(寫結構簡式)_____________________。
(2)在測得的CH3CH2CH2CI化合物的.NMR譜上可觀察到三種峰,而測定化合物CH3CH=CHCl時,卻得到氫原子給出的6個信號峰。根據原子空間排列方式不同,試寫出CH3CH=CHCl分子的空間異構____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com