


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
 甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動.實驗方案如下:
甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動.實驗方案如下:| 1 | 25 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
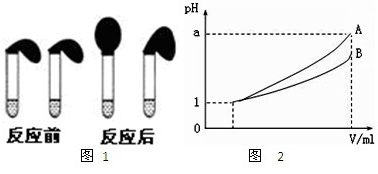
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com