
【題目】X、Y、W、Z是四種常見的短周期元素,其原子半徑隨原子序數表化如下圖所示。已知X的一種核素的質量數為18,中子數為10,Y和Ne原子的核外電子總數相差1;W的單質是一種常見的半導體材料;Z的非金屬性在同周期主族元素中最強。

(1)W位于元素周期表中第 周期第 族。畫出X的陰離子的結構示意圖 。
(2)Z的氫化物和溴化氫相比,較穩定的是 (寫化學式);Z的氫化物與氟化氫相比,沸點較高的是 (寫化學式)。
(3)Y的金屬性與Mg的金屬性相比, (寫化學式)的金屬性強,請用實驗證明它們金屬性的相對強弱: 。
(4)寫出Y的最高價氧化物對應的水化物與Z的最高價氧化物對應的水化物發生反應的化學反應方程式: 。
【答案】(1)三、IVA(各1分)離子結構示意圖略(1分)
(2)HCl(1分);HF(1分);
(3)Na(1分)Na與冷水劇烈反應,而Mg與冷水反應較慢(其它合理答案也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O(2分)
【解析】
試題分析: X、Y、W、Z是四種常見的短周期元素,已知X的一種核素的質量數為18,中子數為10,則X元素原子的質子數為18-10=8,故X為氧元素;Y和Ne原子的核外電子數相差1,X為Na或F,X原子半徑大于氧原子,故X為Na元素;W的單質是一種常見的半導體材料,原子序數大于Na元素,故W為Si元素;Z的吸引電子的能力在同周期主族元素中最大,原子序數大于Si,故Z為Cl元素。(1)W為Si,原子核外電子數為14,有3個電子層,最外層電子數為4,處于周期表中第三周期IVA族;(2)Z為Cl元素,由于元素的非金屬性Cl>Br,故氫化物穩定性HCl>HBr,較穩定的是HCl;由于在HF分子之間存在氫鍵,增加了分子之間的吸引力,所以物質的熔沸點較高的是HF;(3)同周期隨原子序數增大原子半徑減小,原子失去電子的能力逐漸減弱,元素的金屬性逐漸減弱,所以金屬性Na>Mg;元素的金屬性越強,其單質與水貨酸置換出氫氣就越容易。所以可以通過Na與冷水劇烈反應,而Mg與冷水反應較慢證明元素的金屬性Na>Mg;(4)Y的最高價氧化物對應的水化物NaOH是強堿,Z的最高價氧化物對應的水化物HClO4是一元強酸,二者發生酸堿中和反應,產生高氯酸鈉和水,發生反應的化學反應方程式是NaOH+HClO4=NaClO4+H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】
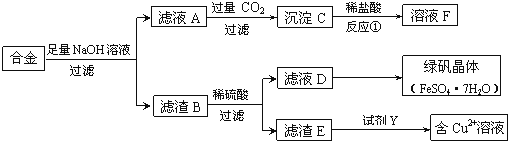
(1)合金與足量氫氧化鈉溶液反應的離子方程式是 。
(2)若D中含有Fe3+,除去Fe3+的常用試劑是 。
(3)若要從濾液D中得到綠礬晶體,必須進行的實驗操作步驟: 、冷卻結晶、過濾、自然干燥。
(4)若由濾渣E得到含Cu2+的溶液,試劑Y可能是 (填選項字母)。
A.稀硝酸 | B.濃硫酸 | C.濃鹽酸 | D.稀硫酸 |
根據所選試劑寫出一個由濾渣E得到含Cu2+溶液的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海藻中含豐富的、以離子形式存在的碘元素。下圖是實驗室從海藻里提取碘的流程的一部分:
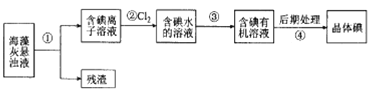
下列判斷正確的是( )
A.步驟①、③的操作分別是過濾、萃取分液
B.可用淀粉溶液檢驗步驟②的反應是否進行完全
C.步驟③中加人的有機溶劑是乙醇
D.步騾④的操作是過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質結構的說法正確的是
A.78 g Na2O2晶體中所含陰、陽離子個數為3NA
B.3.4 g氨氣中含有0.6NA個N—H鍵
C.Na2O2的電子式為:![]()
D.PCl3和BCl3分子中所有原子的最外層都達到8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗的反應原理用離子方程式表示正確的是( )
A. 室溫下,測的氯化銨溶液pH<7,證明一水合氨的是弱堿:NH4++2H2O=NH3·H2O+H3O+
B. 用氫氧化鈉溶液除去鎂粉中的雜質鋁:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氫鈉溶液檢驗水楊酸中的羧基:
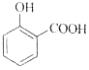 +2HCO3-→
+2HCO3-→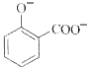 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高錳酸鉀標準溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組進行實驗探究:探究碳、硅元素的非金屬性的相對強弱。實驗裝置如下,請根據要求回答下列問題:
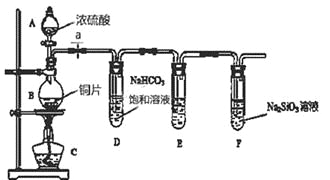
(1)填寫所示儀器名稱:A 。
(2)實驗步驟:連接儀器、 、加藥品后,打開a、然后滴入濃硫酸,加熱。
(3)問題探究:(已知酸性強弱:亞硫酸 >碳酸)
①銅與濃硫酸反應的化學方程式是 ;裝置E中盛足量酸性KMnO4溶液的作用是 。
②該實驗證明碳元素的非金屬性比硅元素非金屬性強的實驗依據是 。
③依據試管D中發生的反應,能否證明硫元素的非金屬性強于碳元素的非金屬性 (填“能”或“否”),原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將1.000 mol·L-1鹽酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示。下列有關說法正確的是( )
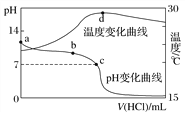
A. a點由水電離出的c(H+)=1.0×10-14 mol·L-1
B. b點:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c點:c(Cl-)=c(NH![]() )
)
D. d點后,溶液溫度略下降的主要原因是NH3·H2O電離吸熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第3周期元素的基態原子中,不可能出現d電子,主要依據是
A. 能量守恒原理
B. 泡利不相容原理
C. 洪特規則
D. 近似能級圖中的順序3d軌道能量比4s軌道高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com