
【題目】【物質結構與性質】 (15 分)
釩、砷均屬于第四周期元素,最高正價均為+5。
I .高純度砷可用于生產具有“半導體貴族”之稱的新型半導體材料GaAs,砷與氯氣反應可得到 AsCl3、AsCl5兩種氯化物。
(1)AsCl3分子的空間構型是 ,中心原子雜化類型是 。兩種氯化物分子中屬于非極性分子的是 。
(2)Ga與As相比,第一電離能較小的元素是 ,GaAs中砷的化合價為 。
II.釩是一種重要的戰略金屬,其最主要的用途是生產特種鋼,其化合價有+5、+4、+3、+2等,工業上從煉鋼獲得的富釩爐渣中(內含 V2O5)提取釩的過程如下。
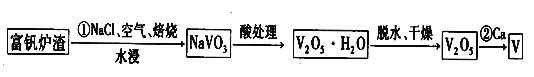
(3)基態釩原子的價電子排布式為 ,寫出反應①的化學方程式: 。
(4)已知單質釩的晶胞為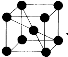 ,則 V 原子的配位數是 ,假設晶胞的邊長為 a cm, 密度為 ρ g/cm3,則釩的相對原子質量為 。
,則 V 原子的配位數是 ,假設晶胞的邊長為 a cm, 密度為 ρ g/cm3,則釩的相對原子質量為 。
【答案】(1)三角錐形;sp3雜化;AsCl5
(2)Ga;-3
(3)3d34s2;2V2O5+4NaCl+O2![]() 4NaVO3+2Cl2
4NaVO3+2Cl2
(4)8;NAρa3/2
【解析】
試題分析:(1)AsCl3分子的價層電子對數為4,含有一對孤對電子,所以立體構型為三角錐形,其中As的雜化軌道類型為sp3。AsCl3分子屬于極性分子,AsCl5分子為正六面體構型,屬于非極性分子。
(2)同周期自左向右原子半徑逐漸減下,則原子半徑Ga大于As,由于As的4p軌道電子處于半充滿狀態,穩定性強,所以第一電離能較小的元素是Ga;GaAs中砷的化合價為-3價。
(3)V為23號元素,根據構造原理知基態釩原子的價電子排布式為3d34s2,根據題給流程知V2O5、NaCl在空氣中焙燒生成NaVO3和氯氣,化學方程式為2V2O5+4NaCl+O2 ![]() 4NaVO3+2Cl2。
4NaVO3+2Cl2。
(4)根據單質釩的晶胞結構知V 原子的配位數是8,利用切割法計算每個晶胞中含有V的數目為8×1/8+1=2,則1mol晶胞的質量為2Mg,晶胞的邊長為 a cm,則1mol晶胞的體積為NAacm3 ,晶胞密度為 ρ g/cm3,則釩的相對原子質量為NAρa3/2。


科目:高中化學 來源: 題型:
【題目】在一個4 L密閉容器中充入6 mol A氣體和5 mol B氣體,在一定條件下發生反應:3 A(g)+B(g) ![]() 2 C(g)+x D(g),經2min后達到平衡狀態,生成了2mol C,經測定D的濃度為0.5molL-1,下列判斷正確的是( )
2 C(g)+x D(g),經2min后達到平衡狀態,生成了2mol C,經測定D的濃度為0.5molL-1,下列判斷正確的是( )
A.X = 3
B.A的轉化率為50%
C.從反應開始到建立平衡,B的反應速率為0.5 molL-1min-1
D.達到平衡時,在相同溫度下容器內混合氣體的壓強是反應前的95%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己知甲、乙、丙、X是四種中學化學中常見的物質,其轉化關系如圖所示。則甲和X不可能是
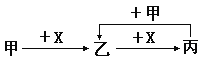
A.甲為c,X為O2 B.甲為SO2,X為NaOH溶液
C.甲為Al2O3,X為NaOH溶液 D.甲為AlCl3,X為NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組關于強電解質、弱電解質、非電解質的歸類,完全正確的是
選項 | 強電解質 | 弱電解質 | 非電解質 |
A | CaCO3 | H2SiO3 | 酒精 |
B | NaCl | NH3 | BaSO4 |
C | Fe | CH3COOH | 蔗糖 |
D | HNO3 | Fe(OH)3 | H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,X與強酸、強堿溶液反應如下,則下列說法正確的是( )
Y![]() X
X![]() Z.
Z.
A.若X為單質鋁,則Y的氣體產物只能是氫氣
B.若X為NaHCO3,則Z一定有CO2
C.若Y、Z為含鋁元素的兩種鹽,則X一定為Al(OH)3
D.若X為乙酸乙酯,則生成物Y、Z中均含有乙醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ在某一容積為5 L的密閉容器內,加入 0.2 mol的CO和0.2 mol的H2O,在催化劑存在和800℃的條件下加熱,發生如下反應:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反應中CO2的濃度隨時間變化情況如下圖:
CO2(g)+H2(g);ΔH>0反應中CO2的濃度隨時間變化情況如下圖: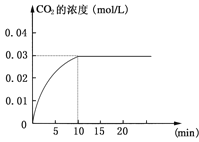
(1)根據上圖數據,反應開始至達到平衡時,CO的化學反應速率為v(CO)= mol/(L·min);反應達平衡時,c(H2)=________ mol/L,該溫度下的平衡常數K 。
(2) 判斷該反應達到平衡的依據是________________。
① CO減少的化學反應速率和CO2減少的化學反應速率相等
② CO、H2O、CO2、H2的濃度都相等
③ CO、H2O、CO2、H2的濃度都不再發生變化
④ 正、逆反應速率都為零
(3)如要一開始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的條件下,反應達平衡時,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,當AgCl開始沉淀時,溶液中![]() 為:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
為:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活、社會發展息息相關。下列說法正確的是
A. 自來水中加入氯氣與污水中加入明礬的原理相同
B. 汽油、甘油、花生油均能發生水解反應和氧化反應
C. 硫酸銅溶液可用于游泳池的消毒是利用了Cu2+能使蛋白質鹽析
D. 現代工業生產中的芳香烴來源于石油的催化重整和煤的干餾
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com