
 隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.
隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.濃度/mol?L-1 時間/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
| △c |
| △t |
| 0.3mol/L-0.21mol/L |
| 10min |
| c(CO2)c(N2) |
| c2(NO) |
| 0.3×0.3 |
| 0.42 |
| c(CO2)c(N2) |
| c2(NO) |
| 0.34×0.17 |
| 0.322 |
 ,
, .
.

 每課必練系列答案
每課必練系列答案科目:高中化學 來源: 題型:閱讀理解

| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 充電 |
| 放電 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |

查看答案和解析>>
科目:高中化學 來源:2013-2014學年河北省邯鄲市高三第一次模擬考試理綜化學試卷(解析版) 題型:填空題
隨著大氣污染的日趨嚴重,國家擬于“十二”五期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%。目前,消除大氣污染有多種方法。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g)??? ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)??? ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l)???? △H= -44.0 kJ·mol-1
寫出CH4(g)與NO2(g)反應生成N2 (g)、CO2 (g)和H2O(1)的熱化學方程式?????????? 。
(2)利用Fe2+、Fe3+的催化作用,常溫下可將SO2轉化為SO42-,從而實現對SO2的治理。已知含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,則另一反應的離子方程式為????????????????????????????????? 。
??? 濃度/mol·L-1
| NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(3)用活性炭還原法處理氮氧化物。有關反應為:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2 (g)+CO2 (g) 。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
①10min~20min以v(CO2) 表示的平均反應速率為 ?????????????????????? 。
②根據表中數據,計算T1℃時該反應的平衡常數為??? ??? (保留兩位小數)。
③一定溫度下,隨著NO的起始濃度增大,則NO的平衡轉化率?????? (填“增大”、“不變”或“減小”) 。
④下列各項能作為判斷該反應達到平衡的是 (填序號字母)。
A.容器內壓強保持不變
B.2v正(NO) = v逆(N2)
C.容器內CO2的體積分數不變
D.混合氣體的密度保持不變
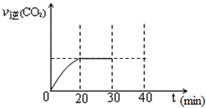
⑤30min末改變某一條件,過一段時間反應重新達到平衡,則改變的條件可能是?????????? 。請在圖中畫出30min至40min 的變化曲線。

查看答案和解析>>
科目:高中化學 來源:2013-2014學年吉林省白山市高三第一次模擬考試理綜化學試卷(解析版) 題型:填空題
(15分)隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%。目前,消除大氣污染有多種方法。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
寫出CH4(g)與NO2(g)反應生成N2 (g)、CO2 (g)和H2O(1)的熱化學方程式 。
(2)利用Fe2+、Fe3+的催化作用,常溫下可將SO2轉化為SO42-,從而實現對SO2的治理。已知含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,則另一反應的離子方程式為 。
(3)用活性炭還原法處理氮氧化物。有關反應為:C(s)+2NO(g) N2(g)+CO2(g)。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2(g)+CO2(g)。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
|
濃度/mol·L-1
|
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反應速率為 。
②根據表中數據,計算T1℃時該反應的平衡常數為 (保留兩位小數)。
③一定溫度下,隨著NO的起始濃度增大,則NO的平衡轉化率 (填“增大”、“不變”或“減小”) 。
④下列各項能作為判斷該反應達到平衡的是 (填序號字母)。
A.容器內壓強保持不變 B.2v正(NO)=v逆(N2)
C.容器內CO2的體積分數不變 D.混合氣體的密度保持不變
⑤30min末改變某一條件,過一段時間反應重新達到平衡,則改變的條件可能是 。請在右圖中畫出30min至40min 的變化曲線。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com