氯氣.氫氣。電解時(shí),總反應(yīng)化學(xué)方程式為
;電解時(shí)所需的精制食鹽水,
通常在粗鹽水中加入某些試劑來除去其中的
Ca2+.Mg2+.Fe3+.SO42-雜質(zhì)離子,添加試劑
的先后順序
(填序號(hào))。
A.BaCl2,Na2CO3,NaOH,HCl
B.Na2CO3,NaOH,BaCl2,HCl
C.BaCl2,NaOH,Na2CO3,HCl
D.NaOH,Na2CO3,BaCl2,HCl
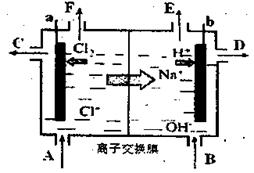
(3)為了避免產(chǎn)物相混合發(fā)生副反應(yīng),工業(yè)上采用離子交換膜法電解食鹽水。下圖為陽(yáng)離子交換膜法電解飽和食鹽水原理示意圖。電極反應(yīng)為:陽(yáng)極
,
下列說法中正確的是
A.從E口逸出的氣體是H2
B.從B中加入含少量NaOH的水溶液以增強(qiáng)導(dǎo)電性
11.3
復(fù)分解存在這樣一個(gè)規(guī)律:一種較強(qiáng)酸與另一種較弱酸的鹽可以自發(fā)地反應(yīng),生成較弱酸和較強(qiáng)酸的鹽,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若換個(gè)角度看,它同時(shí)揭示出另一條規(guī)律,即堿性較強(qiáng)的物質(zhì)發(fā)生類似反應(yīng)可以生成堿性較弱的物質(zhì)。依照該規(guī)律,請(qǐng)判斷下列反應(yīng)不能成立的是_______________________(填編號(hào))。
A.CO2+H2O
+2NaClO===Na2CO3+2HClO
B.CO2+H2O
+NaClO===NaHCO3+HClO
C.CO2
+H2O +C6H5ONa→NaHCO3+C6H5OH
D.CO2
+H2O +2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根據(jù)前述信息判斷,濃度均為0.05 mol/L的下列六種物質(zhì)的溶液中,pH最小的是______(填編號(hào));其pH為_________(填數(shù)值);pH最大的是_________(填編號(hào))。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些復(fù)分解反應(yīng)的發(fā)生還遵循其它的規(guī)律。下列轉(zhuǎn)化都屬于復(fù)分解反應(yīng):
①工業(yè)上將石灰乳與純堿溶液混合可制得苛性鈉溶液
②侯氏制堿法中,向飽和碳酸氫銨溶液中加入飽和食鹽水可獲得小蘇打晶體
③蒸發(fā)KCl和NaNO3混合溶液,首先析出NaCl晶體
根據(jù)上述反應(yīng),總結(jié)出復(fù)分解反應(yīng)發(fā)生的另一規(guī)律:__________________________
____________________________________________________________________;
將足量的KI溶液和AgCl固體混合攪拌,會(huì)觀察到的現(xiàn)象是____________(填序號(hào))
A.固體由白色變?yōu)樗{(lán)色 B.固體由白色變?yōu)辄S色
C.固體由白色變?yōu)樽仙?nbsp; D.固體由白色變?yōu)闇\黃色
請(qǐng)寫出反應(yīng)的離子方程式:______________________________________________。
