
鹽類水解
考點聚焦
1.認識鹽類水解的原理,能解釋強酸弱堿鹽和強堿弱酸鹽的水解。弱酸弱堿鹽的水解不作要求。
2.運用比較、分類、歸納、概括等方法得出鹽類水解規律,探究影響鹽類水解程度的主要因素。
3.能運用鹽類水解的規律判斷常見鹽溶液的酸堿性。
4.會書寫鹽類水解的離子方程式。
5.能舉例說明鹽類水解在生產、生活中的應用。
知識梳理
二、水解的表示
③水解程度一般很小,故方程式用“ ”符號,且產生的物質的濃度太小,一般不用“↑”、“↓”表示;
”符號,且產生的物質的濃度太小,一般不用“↑”、“↓”表示;
④雙水解比單水解程度大,有些可以進行到底。
①強酸弱堿鹽的水解:溶液呈酸性,弱堿陽離子水解
②強堿弱酸鹽的水解:溶液呈堿性,弱酸根離子水解
③弱酸弱堿鹽的水解程度很大,溶液的酸堿性決定與酸堿性的相對強弱
Ⅰ.酸強于堿顯酸性,如(NH4)2SO3
Ⅱ.堿強于酸顯堿性,如NH4CN
Ⅲ.酸堿強弱相當的呈中性,如CH3COONH4
④強酸強堿鹽,不水解,呈中性
⑤弱酸的酸式鹽水解,酸取決于酸根離子的電離程度和水解程度的相對大小
Ⅰ如電離程度大于水解程度,以電離為主,溶液呈酸性,如NaHSO3、NaH2PO4
Ⅱ如水解程度大于電離程度,以水解為主,溶液呈堿性,如NaHCO3、Na2HPO4、NaHS
⑥完全雙水解的鹽,如Al3+與HCO3-、CO32-、S2-、AlO2-等發生雙水解進行到底。
①多元弱酸溶液,根據多步電離分析,如在H3PO4的溶液中,c (H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
②多元弱酸的正鹽溶液根據弱酸根的分步水解分析,如Na2CO3的溶液中,c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)
③不同溶液中同一離子濃度的比較,要看溶液中其他離子對其影響的因素。如在相同的物質的量濃度的下列各溶液中a、NH4Cl b、CH3COONH
④ 混合溶液中各離子濃度的比較,要進行綜合分析,如電解因素、水解因素等。
分別以H2S、NaHS、Na2S為例:
①離子濃度的大小比較:H2S 、NaHS 、Na2S 。
五、電解質溶液中的守恒規律
⑴電荷守恒:電解質溶液中陰、陽離子所帶的正、負電荷數相等,即溶液不顯電性。如磷酸溶液中,c (H+)= c (OH-)+ c(H2PO4-)+
四、溶液中離子濃度大小的比較
⑵物料守恒:就是電解質溶液中某一組分的原始濃度(起始濃度)應該等于它在溶液中各種存在形式的濃度之和。如0.1mol/L的NaHS溶液,0.1= c (HS-)+ c (S2-)+ c (H2S)或
c (Na+)= c (HS-)+ c (S2-)+ c (H2S)
⑶原理守恒:水電離的特征是c (H+)= c (OH-),據此可以得出下列關系如在K2CO3溶液中:c (OH-)= c (H+)+ c (HCO3-)+2(H2CO3)(也稱質子守恒)
例題:分別以①H2S②NaHS③Na2S為例離子濃度的守恒關系:
⑴物料守恒① 、
② ③
⑵電荷守恒:① ②
③ ;
⑶質子守恒:① ②
③ 。
六、鹽類水解的應用
Ⅰ.判斷溶液的酸堿性: ;
Ⅱ.判斷不同弱電解質的相對強弱: ;
Ⅲ.比較溶液中離子濃度:
①同一溶液中不同離子濃度: 、
②不同溶液中相同離子濃度: 。
Ⅳ.解釋某些化學現象及在生產生活中的應用: 。
。
七、離子共存問題的分析
①不能與H+共存的離子有 、
②不能與OH-共存的離子有 、
③不能與HCO3-共存的離子有 、
④不能與Al3+共存的離子有 、
⑤不能與AlO2-共存的離子有 、
⑥不能與Fe3+共存的離子有 、
⑦不能與Fe2+共存的離子有 、
⑧不能與ClO-共存的離子有 、
試題枚舉
[例1] (2006江蘇,13)下列敘述正確的是
A.0.1mol?L-1氨水中,c(OH-)==c(NH4+)
B.10 mL 0.02mol?L-1HCl溶液與10 mL 0.02mol?L-1Ba(OH)2溶液充分混合,若混合后溶液的體積為20 mL,則溶液的pH=12
C.在0.1mol?L-1CH3COONa溶液中,c(OH-)==c(CH3COOH)+c(H+)
D.0.1mol?L-1某二元弱酸強堿鹽NaHA溶液中,c(Na+)==
解析:NH3?H2O是弱電解質,它本身電離所產生的兩種離子濃度相等,得氨水中的部分OH-來自于H2O的電離,所以c(OH-)>c(NH4+),A錯;B項中酸堿中和反應后,
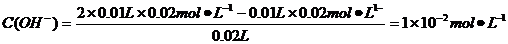
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正確;根據鹽的消解規律,可以判斷C正確;D項中因鈉元素的離子與A原子的物質的量之比為1∶1,對應關系應該為c(Na+)=c(A2-)+c(HA-)+c(H
答案:BC
[例2] (2006四川,12)
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
解析: 氨水與稀硫酸反應,至溶液呈中性,即c(H+)=c(OH-);根據電荷守恒有:c(NH4+)+c(H+)=c(OH-)+
答案: B
[例3] 已知0.1 mol?L-1的二元酸H
A.在Na
B.在溶質物質的量相等的Na
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+
D.在Na
解析:0.1 mol?L-1的強酸pH=1.0,0.1
mol?L-1的H HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H
H H
H H++A2-,溶液中存在HA-、A2-、H+、OH-,所以兩溶液中離子種類相同,A不正確。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以兩溶液中離子種類相同,A不正確。
物質的量相等的Na
由電荷守恒可知c(Na+)+c(H+)=c(HA-)+c(OH-)+
答案: C
[例4]
化合物SOCl2是一種液態化合物,沸點
(1)根據上述實驗,寫出SOCl2和水反應的化學方程式:________________。
(2)AlCl3溶液蒸干灼燒得不到無水AlCl3,而用SOCl2與AlCl3?6H2O混合共熱,可得到無水AlCl3,原因是________________。
解析:水解的本質是化合物中帶正電的基團結合水中電離產生的OH-,而帶負電部分結合水中電離產生的H+。據題給信息分析,產生的刺激性氣體應是SO2,它是由SO2+結合OH-轉化成H2SO3,而另一帶負電的Cl-結合水電離的H+生成HCl,與AgNO3反應生成白色的AgCl沉淀。
答案: (1)SOCl2+H2O====SO2↑+2HCl
(2)因為蒸干AlCl3溶液時,由于AlCl3水解生成的HCl易揮發,而得到Al(OH)3,但當與SOCl2混合共熱時,由于SOCl2極易吸水,防止了AlCl3的水解,有關的化學方程式為6SOCl2+AlCl3?6H2O====6SO2↑+AlCl3+12HCl
[例5]用酚酞、石蕊、0.1mol/L氨水、氯化銨晶體、0.1mol/L鹽酸、熟石灰和蒸餾水,若僅用上述試劑怎樣用簡單實驗方法證明氨水是弱堿?并指出是通過什么途徑證明氨水是弱堿的?
解析:證明氨水是弱堿,可通過兩條途徑:一是證明氨水中存在電離平衡,如方案(1)。另一是證明NH4+作為弱堿陽離子能破壞水的電離平衡發生水解反應,如方案(2)、(3)。
答案: 方案(1)取少量氨水,滴加酚酞,溶液呈紅色,然后向其中加人少量CH3COONH4晶體,振蕩,可看到紅色變淺,說明氨水中存在電離平衡,氨水為弱堿。
方案(2)取少量NH4Cl晶體溶于水,滴加石蕊試液,溶液顯紅色,說明NH4+水解生成了NH3?H2O和HCl,從而破壞了水的電離平衡,亦說明氨水是弱堿。
方案(3)將 0.1mol/L NH3? H2O與0.1mol/L鹽酸等體積混合,再滴加石蕊試劑,溶液顯紅色,說明NH4+水解破壞了水的電離平衡,從而說明氨水是弱堿。
[變式]解釋說明化學事實:向盛有少量Mg(OH)2 懸濁液培養皿中加入適量的飽和氯化銨溶液。現象
討論解釋其原因:同學甲:實驗中存在Mg(OH)2的溶解、結晶平衡: Mg(OH)2(固) 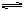 Mg2++2OH-。當加入NH4Cl時,由于NH4+水解,NH4++H2O
Mg2++2OH-。當加入NH4Cl時,由于NH4+水解,NH4++H2O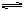 NH3?H2O+H+,使溶液呈酸性。H++OH-=H2O,從而使溶液中[OH-]減小,促進Mg(OH)2溶解,使溶液澄清。同學乙:實驗中加入NH4Cl后,溶液中NH4+可與OH-結合從而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同學的兩種解釋誰的更有道理?
通過實驗來進一步驗證:
。為什么乙更合理?
NH3?H2O+H+,使溶液呈酸性。H++OH-=H2O,從而使溶液中[OH-]減小,促進Mg(OH)2溶解,使溶液澄清。同學乙:實驗中加入NH4Cl后,溶液中NH4+可與OH-結合從而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同學的兩種解釋誰的更有道理?
通過實驗來進一步驗證:
。為什么乙更合理?
答案: Mg(OH)2溶解,使溶液澄清;乙同學的解釋合理;向盛有少量Mg(OH)2懸濁液的培養皿中加入CH3COONH4 固體,觀察懸濁液是否變澄清。CH3COONH4屬弱酸弱堿鹽,雖強烈水解但溶液呈中性。同時,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2沒有溶解,說明甲同學的解釋正確。若Mg(OH)2溶解,則說明乙同學的解釋正確;因為Mg(OH)2比 NH3? H2O的堿性強。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com