
題目列表(包括答案和解析)
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序數依次增大。W原子核外有2個未成對電子,Q是電負性最大的元素,R元素的原子核外的未成對電子數是W原子核外未成對電子數的2倍。請回答下列問題(答題時,W、Y、Z、Q、R用所對應的元素符號表示):
(l)W、Y、Z 三種元素的第一電離能由大到小的順序為 。在上述三種元素的原子中,寫出與WZ2互為等電子體的分子式 。
(2)已知Y2Q2分子存在如下所示的兩種結構(球棍模型,短線不一定代表單鍵)

該分子中Y原子的雜化方式是 雜化。
(3)W2-2陰離子的電子式為 ,Z原子最外層電子排布式為 。
(4)YQ3分子的空間構型為 ,Y和Q兩元素的氫化物的沸點相比較,高者是 (寫分子式).往硫酸銅溶液中通入過量的YH3(Y的氫化物分子式),可生成配離子[Cu(YH3)4]2+,但YQ3不易與Cu2+形成配離子,其原因是 。
(5)科學家通過X射線探明RZ的晶體結構與NaCl晶體結構相似。那么在RZ晶體中距離R2+最近且等距離的R2+有 個。若在RZ晶體中陰陽離子間最近距離為a cm,晶體密度為ρg/cm3,則阿伏伽德羅常數NA的表達式為 mol-1。
(6)已知非整數比化合物R0.95Z,其晶體結構與NaCI相似,但由于R、Z離子個數比小于1:1,故晶體存在缺陷。R0.95Z可表示為( )



 鍵的數目為____ __________________.
鍵的數目為____ __________________. g/cm
g/cm ,阿伏加德羅常數為
,阿伏加德羅常數為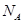 ,求晶胞邊長a=________cm。(用含
,求晶胞邊長a=________cm。(用含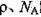 的計算式表示)
的計算式表示)
| A.第一電離能大小:S>P>Si |
| B.電負性順序:C<N<O<F |
| C.因為晶格能Ca0比KCl高,所以KCl比CaO熔點低 |
| D.SO2與CO2的化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大 |

| ||
| ||
| ||
| ||

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com