
【題目】氫化鈣(CaH2)固體是一種儲氫材料,是登山運動員常用的能源提供劑,某化學小組的同學在老師的指導下制備氫化鈣.
[查閱資料]
氫化鈣通常用氫氣與鈣加熱制得.
氫化鈣要密封保存,遇水反應生成氫氧化鈣和氫氣.
鈣遇水立即發生劇烈反應生成氫氧化鈣和氫氣,并放出大量的熱.
標準狀況下氫氣的密度為0.09g/L.
[進行實驗]小組同學設計的制取裝置如圖所示(固定裝置略).

回答下列問題:
(1)寫出A中發生反應的化學方程式______________________________.
(2)B、D中所盛試劑相同,該試劑為_____________,其作用分別是____________________、___________________________.
(3)實驗時先打開A中活塞,一段時間后,再點燃C中酒精燈,其目的是__________________.
(4)裝置C中制取氫化鈣的化學方程式是______________________.
[實驗反思]小組同學通過反思提出問題:上述制得的氫化鈣是否純凈?
他們再次設計實驗進行檢驗,實驗步驟如下:
步驟1:檢查裝置氣密性,裝入足量的水和已稱好質量的氫化鈣樣品,按圖所示連接儀器(固定裝置略).

步驟2:將Y形管傾斜,使A中的水全部進入B中,完全反應后,冷卻至室溫,讀取量筒讀數.
(5)通過上述實驗可分析出制得的氫化鈣是否純凈,其依據是______________________________.
【答案】Zn+H2SO4=ZnSO4+H2↑;濃硫酸干燥氫氣防止空氣中的水蒸汽進入C中;排除裝置內的空氣,防止加熱時產生爆炸;H2+Ca ![]() CaH2;根據實驗得出的氫氣的體積,可計算出氫氣的質量,再根據氫化鈣與水反應的化學方程式,計算出所需氫化鈣的質量,并與氫化鈣樣品質量作對比.
CaH2;根據實驗得出的氫氣的體積,可計算出氫氣的質量,再根據氫化鈣與水反應的化學方程式,計算出所需氫化鈣的質量,并與氫化鈣樣品質量作對比.
【解析】(1)實驗室用稀硫酸和鋅粒反應制取氫氣,化學方程式Zn+H2SO4=ZnSO4+H2↑;
(2)用氫氣與鈣加熱制得氫化鈣,因鈣遇水立即發生劇烈反應生成氫氧化鈣和氫氣,并放出大量的熱,所以與鈣反應的氫氣必須是干燥的氫氣,故制取的氫氣需通過濃硫酸進行干燥,因生成的氫化鈣遇水反應生成氫氧化鈣和氫氣,因此為防止防止空氣中的水蒸汽進入C中,需在D中裝有濃硫酸進行干燥;
(3)點燃不純的氫氣可能會發生爆炸,因此氫氣與鈣加熱反應前需將裝置內的空氣排出,故實驗時先打開A中活塞,一段時間后,再點燃C中酒精燈,以排除裝置內的空氣,防止加熱時產生爆炸;
(4)鈣和氫氣反應在加熱的條件下生成氫化鈣,反應的方程式為H2+Ca![]() CaH2;
CaH2;
【實驗反思】
根據圖示,要驗證氫化鈣是否純凈,可取一定量氫化鈣樣品與水完全反應,根據生成氫氣的質量求出氫化鈣的質量,然后與樣品質量作對比即可。


 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案科目:高中化學 來源: 題型:
【題目】A—J是中學化學常見的物質,它們之間的轉化關系如下圖所示(部分產物已略去)。已知A是一種高熔點物質,常用作耐火材料D是一種紅棕色固體,可用作涂料。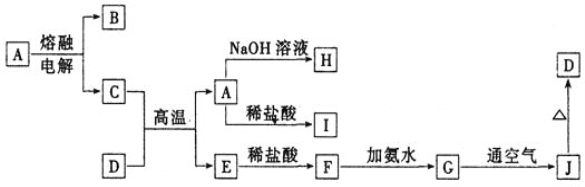
回答下列問題:
(1)A物質的名稱為___________,D的化學式為_________。
(2)G→J的反應現象為______________其化學方程式為:_______________
(3)寫出下列離子方程式:A→H_______________________
F→G _____________________
(4)寫出C+D→A+E的化學方程式為________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將綠豆大小的金屬鈉投入加有酚酞的100mL蒸餾水中,則
A. 溶液變藍 B. Na浮在水面上并熔化成小球
C. Na在水面上游動 D. 有H2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一支試管中放入一塊很小的銅片,再加入少量濃硫酸,然后把試管固定在鐵架臺上。把一小條蘸有品紅溶液的濾紙放入帶有單孔橡皮塞的玻璃管中。塞緊試管口,在玻璃導管口處纏放一團蘸有![]() 溶液的棉花。給試管加熱,觀察現象。當試管中的液體逐漸透明時,停止加熱。
溶液的棉花。給試管加熱,觀察現象。當試管中的液體逐漸透明時,停止加熱。
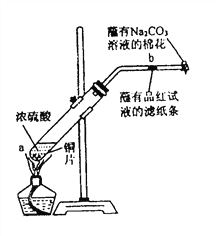
回答下列問題:
(1)寫出a處反應的化學方程式____________________________________________。
(2)試管中的液體反應一段時間后,![]() 處濾紙條的變化為_____________。待試管中反應停止后,給玻璃管放有蘸過品紅溶液的濾紙處微微加熱,濾紙條的變化為_______。
處濾紙條的變化為_____________。待試管中反應停止后,給玻璃管放有蘸過品紅溶液的濾紙處微微加熱,濾紙條的變化為_______。
(3)待試管中液體冷卻后,將試管上層液體倒去,再慢慢加入少量水,可觀察溶液呈______色。
(4)玻璃導管口處纏放一團蘸有Na2CO3溶液的棉花所起的作用是____________
(5)如果濃硫酸的濃度為![]() ,銅片是過量的,加熱使之反應,當被還原的硫酸為
,銅片是過量的,加熱使之反應,當被還原的硫酸為![]() 。則濃硫酸的實際體積_____________(填寫“大于”、“等于”或“小于”)
。則濃硫酸的實際體積_____________(填寫“大于”、“等于”或“小于”)![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制2mol/L的NaCl溶液950mL時應選用的容量瓶的規格和NaCl質量分別是( )
A.950mL 111.2g
B.1000mL 117g
C.1000mL 111.2g
D.950mL 117g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有 4種(不考慮立體異構)
的一溴代物都有 4種(不考慮立體異構)
B. CH3CH=CHCH3分子中的四個碳原子在同一直線上
C. 按系統命名法,化合物![]() 的名稱是 2,3,4-三甲基-2-乙基戊烷
的名稱是 2,3,4-三甲基-2-乙基戊烷
D. ![]() 和
和![]() 都是α-氨基酸且互為同系物
都是α-氨基酸且互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至過量。經測定,加入的NaOH的物質的量(mol)和所得沉浮的物質的量(mol)的關系如右圖所示。則:
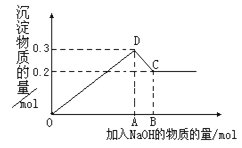
(1)寫出代表各線段發生反應的離子方程式:
OD段______________________________,
DC段______________________________。
(2)原溶液中Mg2+、Al3+物質的量濃度之比為___________。
(3)圖中C點表示當加入_______mol NaOH時,Al3+已經轉化成____________。
(4)圖中線段OA∶AB=__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的分類合理的是
A. 氧化物:CO2、NO、SO2、H2O
B. 堿:NaOH、KOH、Ba(OH)2、Na2CO3
C. 銨鹽:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 堿性氧化物:Na2O、CaO、Mn2O7、Al2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】焊接鋼鐵時常用的焊藥為氯化銨,其作用是消除焊接處的鐵銹。發生的反應體系中共有六種物質:NH4Cl、N2、Fe2O3、Fe 和 X。
(1)根據題意,可判斷出X是_____________(寫化學式)
(2)寫出并配平該反應的化學方程式,并用雙線橋標出電子轉移的方向和數目:________________。
(3)在反應 3BrF3+5H2O=HBrO3+Br2+9HF+O2 中,被氧化的元素是____________,當有5 mol水反應時,由H2O還原的BrF3為______________mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com