
題目列表(包括答案和解析)
平衡是化學反應原理中的重要內容。按要求回答下列問題:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常數為K1
2SO3(g) ΔH1 平衡常數為K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常數為K2
2NO2(g) ΔH2 平衡常數為K2
則反應NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反應該溫度下的平衡常數K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反應該溫度下的平衡常數K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),該反應在3L密閉容器中,在兩種不同的條件下進行反應,A、B的起始物質的是分別為3.0mol和6.0mol,其中實驗I的條件為T1℃。A的物質的量隨時間的變化如圖所示。
C(g)+D(g),該反應在3L密閉容器中,在兩種不同的條件下進行反應,A、B的起始物質的是分別為3.0mol和6.0mol,其中實驗I的條件為T1℃。A的物質的量隨時間的變化如圖所示。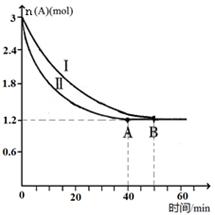
①實驗Ⅱ可能改變的條件是_______________。
②T1℃時該反應的平衡常數為_____(用分數表 示),達到平衡時,A的反應速率為____。
(3)已知HCN溶液的電離平衡常數Ka=10-5mol?L-1,c平衡(HCN)≈c起始(HCN),水的電離可不計,則此溫度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)對于0.1mol?L-1 Na2CO3溶液,該溶液中離子濃度由大到小的順序是______,向該溶液中加水稀釋的過程中,c(H2CO3)逐漸____(填“增大”“不變”或“減小”, 下同) ,c(H2CO3)/ c(CO32-)逐漸______。
 2SO3(g) ΔH1 平衡常數為K1
2SO3(g) ΔH1 平衡常數為K1 2NO2(g) ΔH2 平衡常數為K2
2NO2(g) ΔH2 平衡常數為K2 SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反應該溫度下的平衡常數K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反應該溫度下的平衡常數K=______(用K1和K2表示)。 C(g)+D(g),該反應在3L密閉容器中,在兩種不同的條件下進行反應,A、B的起始物質的是分別為3.0mol和6.0mol,其中實驗I的條件為T1℃。A的物質的量隨時間的變化如圖所示。
C(g)+D(g),該反應在3L密閉容器中,在兩種不同的條件下進行反應,A、B的起始物質的是分別為3.0mol和6.0mol,其中實驗I的條件為T1℃。A的物質的量隨時間的變化如圖所示。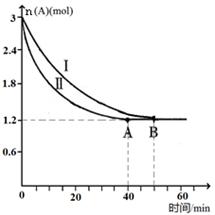
(14分) 甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:?
(1)以天然氣為原料制H2是合成氨的一條重要的路線。甲烷的部分氧化可得到合成氨的原料氣H2,其反應式如下:
①CH(g)+1/2O
(g)=CO(g)+2H
(g)
H1=-35.6kJ·mol
試判斷常溫下,上述反應能否自發進行: (填”能”或”否”)。有研究認為甲烷部分氧化的機理為:
②CH(g)+2O
(g)=CO2(g)+2H2O(g)
H2=-890.3kJ·mol
③CH(g)+CO
(g)=2CO(g)+2H
(g)
H3=247.3kJ·mol
請結合以上條件寫出CH4和H2O(g)生成CO和H2的熱化學反應方程式:
。
⑵恒溫下,向一個2L的密閉容器中充入1molN2和2.6 molH2,反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
實驗數據
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此條件下,該反應達到化學平衡時,氮氣的濃度為 。
(3)如下圖所示,裝置Ⅰ為甲烷燃料電池(電解質溶液為KOH溶液),通過裝置Ⅱ實現鐵棒上鍍銅。?
①b處電極上發生的電極反應式是 。
②電鍍結束后,裝置Ⅰ中溶液的pH (填寫“變大”、“變小”或“不變”,下同),裝置Ⅱ中Cu的物質的量濃度 。
③若完全反應后,裝置Ⅱ中陰極質量增加12.8g,則裝置Ⅰ中理論上消耗甲烷 L (標準狀況下)。
(14分) 甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:?
(1)以天然氣為原料制H2是合成氨的一條重要的路線。甲烷的部分氧化可得到合成氨的原料氣H2,其反應式如下:
①CH (g)+1/2O
(g)+1/2O (g)=CO(g)+2H
(g)=CO(g)+2H (g)
(g)  H1=-35.6kJ·mol
H1=-35.6kJ·mol
試判斷常溫下,上述反應能否自發進行: (填”能”或”否”)。有研究認為甲烷部分氧化的機理為:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
請結合以上條件寫出CH4和H2O(g)生成CO和H2的熱化學反應方程式:
。
⑵恒溫下,向一個2L的密閉容器中充入1 molN2和2.6 molH2,反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
實驗數據
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

 的物質的量濃度 。
的物質的量濃度 。(14分) 甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:?
(1)以天然氣為原料制H2是合成氨的一條重要的路線。甲烷的部分氧化可得到合成氨的原料氣H2,其反應式如下:
①CH (g)+1/2O
(g)+1/2O (g)=CO(g)+2H
(g)=CO(g)+2H (g)
(g)  H1=-35.6kJ·mol
H1=-35.6kJ·mol
試判斷常溫下,上述反應能否自發進行: (填”能”或”否”)。有研究認為甲烷部分氧化的機理為:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
請結合以上條件寫出CH4和H2O(g)生成CO和H2的熱化學反應方程式:
。
⑵恒溫下,向一個2L的密閉容器中充入1 molN2和2.6 molH2,反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
實驗數據
|
時間/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/( mol ·/L-1) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
此條件下,該反應達到化學平衡時,氮氣的濃度為 。
(3)如下圖所示,裝置Ⅰ為甲烷燃料電池(電解質溶液為KOH溶液),通過裝置Ⅱ實現鐵棒上鍍銅。?

①b處電極上發生的電極反應式是 。
②電鍍結束后,裝置Ⅰ中溶液的pH
(填寫“變大”、“變小”或“不變”,下同),裝置Ⅱ中Cu 的物質的量濃度
。
的物質的量濃度
。
③若完全反應后,裝置Ⅱ中陰極質量增加12.8g,則裝置Ⅰ中理論上消耗甲烷 L (標準狀況下)。
2008.10
一、選擇題(1---10題每空2分,11―20題每空3分;共50分)
1
2
3
4
5
6
7
8
9
10
B
A
A
D
C
B
B
A
D
C
11
12
13
14
15
16
17
18
19
20
B
D
A
A
B
D
D
A
C
C
二.填空題 (21題9分,22題9分。共18分)
21. (每空3分,共9分)
(1)N2H4(l)+2H2O2(l)=N2(g) +4H2O(g) △H=-644.25 KJ/mol
(2)410.125
(3)產物不會造成環境污染。
22. (每空2-3分 共9分)
(1) ;(3分)
;(3分)
(2)吸熱; (2分)
(3)b、c; (2分)
(4)830 (2分)
三.實驗題和推斷題(23題12 分,24題 9分, 共21分)
23.(每問2分,共12分)
(1)環形玻璃攪拌棒 (2分)
(2)減少實驗過程中的熱量損失 (2分)
(3)偏小 (2分)
(4)不相等;相等; (4分)
(5)偏小 (2分)
24.(每空3分 共9分)
(1)2Al + 6H+ = 2Al3+ + 3H2↑ (3分)
(2)反應放出熱量,溫度升高,使化學反應速率加快(3分)
(3)(說明:可能存在多種假設,但只要假設合理均可)Cl-能夠促進金屬鋁與H+反應;SO42- 對H+與金屬鋁的反應起阻礙作用。(3分)
【解析】氫離子濃度和鋁片均相同,造成的差異應該與反應
(即2Al + 6H+ = 2Al3+ + 3H2↑)所處環境的不同(Cl- 和SO42-)有關。
四.計算題 (12分)
25.(每空2分,共6分)
2mol/(L?min);
1mol/(L?min);
2mol/L
26.(6分)
⑴x=4
⑵ >
⑶ C
(第四問選做)
(每空3分,共6分)
(4) a/4;
2.4+
(解析)
由已知得 消耗B=0.2mol 生成C 0.4mol/L*
所以x=4
由于此反應方程式前后系數和相等,則壓強變化對平衡不起作用,所以只需把所有物質化到一邊,使物質的量成比例即可。原平衡前為A:B=3:2,題中加入amolC,就是
原平衡時A,B,C的摩爾比為2.4:1.8:0.8,新平衡也滿足這個比例
x/(a-4x/3)=3 所以x=
所以n(A)=(2.4+
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com