
題目列表(包括答案和解析)
物質在水溶液中可能存在電離平衡、鹽的水解平衡或沉淀溶解平衡,它們都可看做是化學平衡的一種.請根據所學化學知識回答下列問題:
Ⅰ、已知0.01 mol/L的NaHCO3溶液呈堿性.
(1)
該溶液中存在著三個平衡體系,用電離方程式或離子方程式表示:①________
②________
③________
.(2)
溶液中共有________種不同的粒子(指分子和離子).(3)該溶液中的離子濃度由大到小的順序是:________.
(4)向該溶液中加入AlCl3溶液,有白色膠狀沉淀生成,同時產生一種無色無味并能使澄清石灰水變渾濁的氣體,寫出該反應的離子方程式:________.
Ⅱ、有鹽酸、硫酸、醋酸三種溶液,試回答:
(1)若三種溶液的濃度均為0.1 mol·L-1,其c(H+)依次為a mol·L-1,b mol·L-1,c mol·L-1,其大小順序為________;中和一定量NaOH溶液生成正鹽時,需上述三種酸的體積依次是V1 L、V2 L、V3 L,其大小關系為________.
(2)若三種溶液的pH都為2,分別取10 mL上述溶液加水稀釋至1000 mL,此時三種溶液的pH1、pH2、pH3之間的關系為________(用“<”、“>”或“=”表示,pH1-代表鹽酸、pH2-代表硫酸、pH3-代表醋酸)
Ⅲ、已知含有足量AgCl固體的飽和溶液中存在如下平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
且在25℃時,AgCl的K sp=1.8×10-10.現將足量AgCl固體分別放入下列液體中:
①100 mL蒸餾水
②100 mL0.3 mol/L AgNO3溶液
③100 mL0.1 mol/L MgCl2溶液充分攪拌后冷卻到25℃時,此時c(Ag+)由大到小的順序為________(填序號),溶液②中c(Cl-)=________.
化學學科中的平衡理論主要包括:化學平衡、電離平衡和水解平衡三種,且均符合勒夏特列原理。請回答下列問題:
Ⅰ、在恒容密閉容器中,發生反應3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列問題:
2C(g) ΔH=Q kJ/mol。回答下列問題:
(1)寫出該反應平衡常數的表達式__________。
(2)下列各項能作為判斷該反應達到化學平衡狀態的依據是________(填序號)。
① v(A)=3v(B) ②混合氣體的密度保持不變
③有3 mol A消耗的同時有1 mol B生成 ④C的濃度保持不變
(3)根據實驗測得的數據可知,溫度越高該反應的化學平衡常數越大,則Q______0(填“大于”或“小于”)。
Ⅱ、(1)室溫下,取pH=2的鹽酸和醋酸溶液各100 mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示。則圖中表示醋酸溶液中pH變化曲線的是________(填 “a”或“b”)。設鹽酸中加入Zn質量為m1,醋酸溶液中加入的Zn質量為m2,則m1________m2(選填“<”、“=”或“>”)。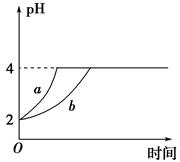
(2)若室溫下pH=2的鹽酸和醋酸溶液各 100 mL,分別加水稀釋后使pH=4,設鹽酸中加入水的體積為V1,醋酸溶液中加入的水的體積為V2,則 V1______V2(填“<”“=”或“>”)。
Ⅲ、常溫下,濃度均為0.1 mol/L 的下列六種溶液的pH如下表:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
化學學科中的平衡理論主要包括:化學平衡、電離平衡和水解平衡三種,且均符合勒夏特列原理。請回答下列問題:
Ⅰ、在恒容密閉容器中,發生反應3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列問題:
2C(g) ΔH=Q kJ/mol。回答下列問題:
(1)寫出該反應平衡常數的表達式__________。
(2)下列各項能作為判斷該反應達到化學平衡狀態的依據是________(填序號)。
① v(A)=3v(B) ②混合氣體的密度保持不變
③有3 mol A消耗的同時有1 mol B生成 ④C的濃度保持不變
(3)根據實驗測得的數據可知,溫度越高該反應的化學平衡常數越大,則Q______0(填“大于”或“小于”)。
Ⅱ、(1)室溫下,取pH=2的鹽酸和醋酸溶液各100 mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示。則圖中表示醋酸溶液中pH變化曲線的是________(填 “a”或“b”)。設鹽酸中加入Zn質量為m1,醋酸溶液中加入的Zn質量為m2,則m1________m2(選填“<”、“=”或“>”)。

(2)若室溫下pH=2的鹽酸和醋酸溶液各 100 mL,分別加水稀釋后使pH=4,設鹽酸中加入水的體積為V1,醋酸溶液中加入的水的體積為V2,則 V1______V2(填“<”“=”或“>”)。
Ⅲ、常溫下,濃度均為0.1 mol/L 的下列六種溶液的pH如下表:
|
溶質 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
(1)上述鹽溶液中的陰離子,結合H+能力最強的是
(2)根據表中數據判斷,濃度均為0.01 mol/L 的下列五種物質的溶液中,酸性最強的是_______ (填編號) ; 將各溶液分別稀釋100倍, pH變化最小的是 (填編號) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)據上表數據,請你判斷下列反應不能成立的是 (填編號)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其濃的水溶液呈較強酸性;SOCl2 (氯化亞砜)極易和水發生如下反應:SOCl2+H2O=SO2+2HCl。實驗室中制取無水氯化鋅采用ZnCl2·xH2O與SOCl2混合加熱的方法。試回答:
SOCl2的作用是___________________________________。
化學學科中的平衡理論主要包括:化學平衡、電離平衡和水解平衡三種,且均符合勒夏特列原理。請回答下列問題:
Ⅰ、在恒容密閉容器中,發生反應3A(g)+B(g)![]() 2C(g) ΔH=Q kJ/mol。回答下列問題:
2C(g) ΔH=Q kJ/mol。回答下列問題:
(1)寫出該反應平衡常數的表達式__________。
(2)下列各項能作為判斷該反應達到化學平衡狀態的依據是________(填
序號)。
① v(A)=3v(B) ②混合氣體的密度保持不變
③有3 mol A消耗的同時有1 mol B生成 ④C的濃度保持不變
(3)根據實驗測得的數據可知,溫度越高該反應的化學平衡常數越大,則Q______0(填“大于”或“小于”)。
Ⅱ、(1)室溫下,取pH=2的鹽酸和醋酸溶液各100 mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示。則圖中表示醋酸溶液中pH變化曲線的是________(填“a”或“b”)。設鹽酸中加入Zn質量為m1,醋酸溶液中加入的Zn質量為m2,則m1________m2(選填“<”、“=”或“>”)。


(2)若室溫下pH=2的鹽酸和醋酸溶液各 100 mL,分別加水稀釋后使pH=4,設鹽酸中加入水的體積為V1,醋酸溶液中加入的水的體積為V2,則 V1______V2(填“<”“=”或“>”)。
Ⅲ、常溫下,濃度均為0.1 mol/L 的下列六種溶液的pH如下表:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述鹽溶液中的陰離子,結合H+能力最強的是
(2)根據表中數據判斷,濃度均為0.01 mol/L 的下列五種物質的溶液中,酸性最強的是_______ (填編號) ; 將各溶液分別稀釋100倍, pH變化最小的是 (填編號) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)據上表數據,請你判斷下列反應不能成立的是 (填編號)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其濃的水溶液呈較強酸性;SOCl2 (氯化亞砜)極易和水發生如下反應:SOCl2+H2O=SO2+2HCl。實驗室中制取無水氯化鋅采用ZnCl2·xH2O與SOCl2混合加熱的方法。試回答:
SOCl2的作用是___________________________________。
 2C(g) ΔH=Q kJ/mol。回答下列問題:
2C(g) ΔH=Q kJ/mol。回答下列問題: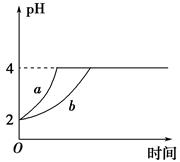
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
一、選擇題(本題包括9小題,每小題3分,共27分。每小題只有一個選項符合題意。)
題號
1
2
3
4
5
6
7
8
9
答案
B
B
A
D
C
C
A
D
B
二、選擇題(本題包括9小題,每小題4分,共36分。每小題有一個或兩個選項符合題意。若正確答案包括兩個選項,只選一個且正確的給2分,但只要選錯一個,該小題就為0分。)
題號
10
11
12
13
14
15
16
17
18
答案
C
C
CD
BD
D
BC
B
BD
AC
三、(本題包括3小題,共34分)
19.(11分)
(1)CO32- + H2O
 HCO3- + OH- (2分)(配平、化學式錯得0分,寫等號扣1分)
HCO3- + OH- (2分)(配平、化學式錯得0分,寫等號扣1分)
(2)不再有氣泡產生(或只有極少量氣泡產生) (1分)
(3)若控制不準確溫度過高Fe2+易被氧化;由于有氫氣生成,明火加熱不安全 (2分)
(兩個方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化學式錯得0分,配平錯扣1分)
(5)6.6 (2分) (多寫單位g不扣分)
(6)循環使用 (2分)(具體說出如何循環使用同樣得分,意思相近表達欠清晰扣1分)
20.(11分)
(1)2MnO4- + 5H
(化學式錯得0分,配平錯扣1分,漏↑扣1分,扣完為止)
(2)4 (2分)
(3)① 反應開始時:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反應時間: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反應速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成計算且結果正確得3分,結果錯誤得0分。速率單位錯誤扣1分)
② 否(或:不可行) (1分) 取過量的體積相同、濃度不同的草酸溶液分別同時與體積相同、濃度相同的高錳酸鉀酸性溶液反應。(3分)
(基本思路錯誤得0分,思路正確未強調草酸過量扣1分,未強調體積相同扣1分)
21.(12分)
(1)7 (1分)
實驗操作
預期現象和結論
步驟1:用藥匙取少量白色粉末于試管A底部,點燃酒精燈,充分加熱試管。
(1分)
白色粉末減少,有白煙生成,試管上部有白色固體凝結,說明原白色粉末含有NH4Cl。(2分)
步驟2:用藥匙取少量試管A中的殘留固體于試管B中,滴加適量蒸餾水,振蕩。(1分)
固體溶解得無色溶液。(1分)
步驟3:向試管B中滴加過量的 Ba(NO3)2溶液和1mol?L-1硝酸,充分振蕩后靜置。(2分)
有白色沉淀生成,證明原白色粉末含有 K2SO4。(1分)
步驟4:取試管B中上層清液少量于試管C中,滴加 AgNO3溶液和1mol?L-1硝酸。(2分)
有白色沉淀生成,證明原白色粉末含有NaCl。(1分)
(3)
(NH4Cl的檢驗用NaOH溶液和紅色石蕊試紙同樣得3分;另取樣品溶于水進行K2SO4的檢驗同樣得2分;NaCl的檢驗必須包含有上述4個步驟的操作,共6分(著重號為關鍵點);步驟設計不合理,次序混亂酌情扣分。)
四、(本題包括3小題,共34分)
22.(10分)
(1)①  (1分)
(1分)
② 取形狀大小相同的鎂片和鋁片分別與體積相同、濃度相同的稀鹽酸反應,觀察產生氣泡的快慢 (2分)(操作1分,觀察指標1分。著重號部分缺一處扣1分。用金屬與沸水反應、等濃度鹽溶液堿性比較等合理方法均得分,方案無可行性不給分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化學式錯得0分,配平錯扣1分)
有白色膠狀沉淀生成,有無色刺激性氣味氣體產生 (2分)
(各占1分,著重號部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 強 (1分)
23.(12分)
(1)Ba2+ + SO42- = BaSO4↓ Mg2+ + 2OH- = Mg(OH)2↓
Ca2+ + CO32- = CaCO3↓ Ba2+ + CO32- = BaCO3↓ (4分)
(每個1分。符號錯誤、漏↓得0分)
(2)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (2分)
2NaOH + H2↑+ Cl2↑ (2分)
(化學式錯得0分,配平錯扣1分,漏↑扣1分,漏條件扣1分,扣完為止)
(3)制漂白粉、生產鹽酸、自來水消毒、制高純硅、合成塑料等(任寫2種) (2分)
(寫對1個得1分。答案多于2個的按前2個答案評分。)
(4)蒸發濃縮(1分) 過濾(1分) (多寫冷卻不得分也不扣分)
蒸發過程中溶劑(水)大量減少,Na+濃度顯著增加促進NaCl的沉淀溶解平衡向沉淀方向移動(或:Na+濃度顯著增加抑止了NaCl的溶解) (2分)
(兩個因素各占1分。后者從溶度積角度作答敘述正確也給分。)
24.(12分)
(1)增大 (1分)
(2)向左移 (1分)
 (3)(4分)
(3)(4分)
(各占2分,起點位置、曲線走勢、終點與原曲線的相對高低等只要有一處錯誤則得0分。)
(4)(4分)
0.60(2分)
ν正_>_ν逆(2分)
(5)-787.0 (2分)(不帶負號得0分,有效數字不準確扣1分。)
五、(本題包括1小題,共9分)
 25.(9分)
25.(9分)
(1) (2分)(有錯即得0分)
 |
(2分)(漏系數n扣1分,漏條件不扣分)
 |
(2) (2分)

(3) (2分)
(漏系數2扣1分,不寫條件不扣分)
(4)A、B (2分) (漏選1個扣1分,多選一個也扣1分,扣完為止。)
六、選做題(本題包括2小題,每小題10分。考生只能選做一題)
26.(10分)
 (1)① 碳碳雙鍵、羧基 (2分)(寫對一種得1分,錯別字不給分,多寫一個扣1分)
(1)① 碳碳雙鍵、羧基 (2分)(寫對一種得1分,錯別字不給分,多寫一個扣1分)
② (3分)
(2) (5分)
