實驗室常用的干燥劑“堿石灰”是CaO和NaOH固體的混合物,極易與空氣中水蒸氣和CO
2反應而變質.同學們?yōu)榇_認一瓶久置的“堿石灰”樣品的成分,進行如下實驗探究.
(1)【猜想】
猜想Ⅰ:沒有變質,“堿石灰”中只含有CaO、固體NaOH;
猜想Ⅱ:已完全變質,“堿石灰”全部變成了CaCO
3和 Na
2CO
3(2)【實驗】如圖所示:
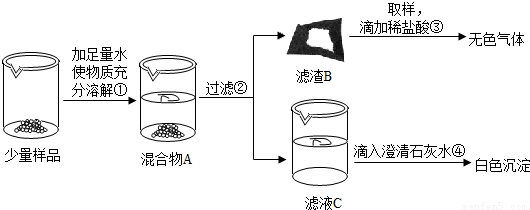
實驗過程中,同學們還發(fā)現向樣品中加入足量水溶解時放出大量的熱.
(3)【判斷】
a.若Ca(OH)
2、CaCO
3和Na
2CO
3溶于水無明顯的溫度變化,則猜想Ⅱ______;(填“成立”或“不成立”)
b.操作③發(fā)生反應的化學方程式為______;
由操作④的現象判斷:濾液C中的溶質一定含有______(寫化學式);
由此判斷猜想Ⅰ______(填“成立”或“不成立”)
c.綜合a和b的結論,判斷該樣品變質情況為______(填“全部變質”或“部分變質”)
下列對樣品成分的分析正確的是______(填序號).
①樣品中一定含NaOH
②樣品中一定含Na
2CO
3③樣品中含NaOH、CaO中的一種或兩種
【拓展】由上述實驗說明,實驗室中“堿石灰”應______保存;操作②中玻璃棒的作用是______.




 金牌教輔培優(yōu)優(yōu)選卷期末沖刺100分系列答案
金牌教輔培優(yōu)優(yōu)選卷期末沖刺100分系列答案

