解:(1)硫化氫氣體在空氣中燃燒生成的是水和二氧化硫;反應方程式為:2H
2S+3O
2
2SO
2+2H
2O;
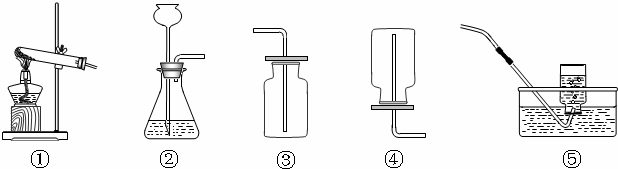
(2)①制取硫化氫是用的固態硫化亞鐵和液態稀硫酸,而且反應不需要加熱;所以氣體發生裝置可以選擇制B裝置;
②y因為硫化氫密度比空氣大,若用C裝置收集H
2S氣體,進氣口應為長管b;
③酸能使紫色石蕊試液變紅,為了驗證硫化氫的水溶液呈酸性,可將氣體通入裝置D.D中所盛的試劑應該是紫色石蕊試劑;反應現象為溶液變紅;
④硫化氫溶于水形成酸,所以用堿液吸收,所以為了防止多余的H
2S氣體逸出污染環境,可將其通入裝置E吸收.E中試劑為NaOH溶液;
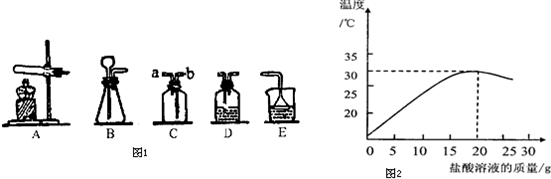
(3)①觀察坐標看出隨著鹽酸的加入,發生中和反應,溶液的溫度逐漸升高,因此反應是放熱的;
②由于鹽酸與氫氧化鈉反應生成氯化鈉和水,加入25g鹽酸溶液時鹽酸過量,所以反應后的溶液中含有氯化鈉、鹽酸,氯化鈉電離出鈉離子和氯離子,鹽酸中電離出氫離子和氯離子,溶液中還存在水分子;
③解:設40克該氫氧化鈉溶液中溶質的質量為x,根據題意可知加入鹽酸為20克時恰好完全反應
NaOH+HCl═NaCl+H
2O
40 36.5
x 20gⅹ7.3%

=

x=1.6 g
氫氧化鈉溶液的溶質質量分數:

ⅹ100%=4%
答:該氫氧化鈉溶液中溶質質量分數4%.
故答案為:(1)2H
2S+3O
2
2SO
2+2H
2O;
(2)①B; ②b; ③紫色石蕊試液; ④氫氧化鈉溶液(其他合理答案均可)
(3)①放熱;②H
2O、Na
+、Cl
-和H
+③解:設40克該氫氧化鈉溶液中溶質的質量為x,根據題意可知加入鹽酸為20克時恰好完全反應
NaOH+HCl═NaCl+H
2O
40 36.5
x 20gⅹ7.3%

=

x=1.6 g
氫氧化鈉溶液的溶質質量分數:

ⅹ100%=4%
答:該氫氧化鈉溶液中溶質質量分數4%.
分析:(1)根據硫化氫燃燒的反應實際是硫化氫與空氣中的氧氣反應生成水和二氧化硫的反應,據此即可寫出反應的化學方程式;
(2)實驗室是用硫化亞鐵和硫酸反應生成硫酸亞鐵和硫化氫氣體:
①根據反應物的狀態和反應的條件可以選擇氣體的發生裝置;②根據氣體密度與空氣密度的比較可以選擇氣體的收集裝置;③根據酸能使紫色石蕊試液變紅進行解答;④根據硫化氫溶于水形成酸,所以用堿液吸收進行解答;
(3)①根據坐標分析熱量變化來考慮;②加入25g鹽酸溶液時鹽酸過量,通過分析反應后存在的溶質考慮溶液中的離子;③根據圖象可知反應完畢消耗鹽酸的質量為20g,再乘以鹽酸的質量分數,算出氯化氫的質量,再通過計算算出氫氧化鈉的質量,再除以氫氧化鈉溶液的質量即可.
點評:掌握常見的發生裝置和收集裝置,能夠根據反應物的狀態和反應條件,來選擇合適的發生裝置,根據氣體的密度及水溶性來選擇收集裝置;在分析中和反應時,反應后溶液中的離子要考慮反應后溶液中的溶質;解答本題還需要結合圖表中數據分析出參加反應的氯化氫的質量.

 2SO2+2H2O;
2SO2+2H2O; =
=
 ⅹ100%=4%
ⅹ100%=4%  2SO2+2H2O;
2SO2+2H2O; =
=
 ⅹ100%=4%
ⅹ100%=4%