
據報道,化工生產中產生的含銅廢料,在通入空氣并加熱的條件下,能與稀硫酸反應轉化為硫酸銅。(2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O)現有溶質的質量分數為10%的稀硫酸(其中含溶質98 g)與銅恰好完全反應,假設硫酸不和其他雜質反應,求反應后硫酸銅溶液中溶質的質量分數。(最后結果精確到0.1%)
2CuSO4 + 2H2O)現有溶質的質量分數為10%的稀硫酸(其中含溶質98 g)與銅恰好完全反應,假設硫酸不和其他雜質反應,求反應后硫酸銅溶液中溶質的質量分數。(最后結果精確到0.1%)
15.1%
解析試題分析:反應后硫酸銅溶液中溶質的質量分數等于溶質硫酸銅的質量除以反應后溶液的質量再乘以百分之一百。溶質硫酸銅的質量可利用化學方程式計算出來。
解:設生成的溶質硫酸銅的質量為X ,參加反應的銅的質量為y ,氧氣的質量為z:
2Cu + 2H2SO4 + O2 =2CuSO4 + 2H2O
128 196 32 320
y 98g z X
196/320 = 98g/X 196/128 =98g/y 196/32 =98g/z
X=160g y =64g z =16g
反應后溶液的質量=" 64g" +16g +(98÷10%)=1060g
反應后硫酸銅溶液中溶質的質量分數=160g/1060g ×100% =15.1%
考點:有關溶質質量分數的計算


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:初中化學 來源: 題型:計算題
汽車蓄電池中稀硫酸的溶質質量分數為28%,密度為1.2克/厘米3。若要在實驗室用溶質質量分數為98%的濃硫酸配制這種稀硫酸630 克。求:
(1)630 克稀硫酸的體積是多少毫升?
(2)需要濃硫酸多少克?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
乙炔(C2H2)是一種重要的化工原料,實驗室常用碳化鈣(CaC2)與水反應制取乙炔,該反應方程式為:CaC2 + 2H2O =Ca(OH)2 + C2H2↑。計算:要制取52g乙炔氣體,需要碳化鈣的質量。
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
我國是世界鋼鐵產量最大的國家,煉鐵的主要原料是鐵礦石。
(1)用赤鐵礦石(主要成分為Fe2O3)煉鐵的反應原理為:
(2)Fe2O3中鐵元素的質量分數為:
(3)根據化學方程式計算:用含Fe2O360%的赤鐵礦石800 t,理論上可煉出純鐵多少噸?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
實驗室需用氯酸鉀制取氧氣,化學方程式: 2 KClO3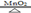 KCl + 3O2↑。現將 29.4g 氯酸鉀與 5.6g 二氧化錳的混合物加熱一段時間后,冷卻,稱量剩余固體的質量為 25.4g。回答:
KCl + 3O2↑。現將 29.4g 氯酸鉀與 5.6g 二氧化錳的混合物加熱一段時間后,冷卻,稱量剩余固體的質量為 25.4g。回答:
(1)生成氧氣的質量是多少?
(2)剩余固體中氯化鉀質量是多少?
(3)固體剩余物中是否還含有氯酸鉀?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
將銅和氧化銅固體混合物粉末11.2g放入燒杯中,當加入稀硫酸100 g時,氧化銅與硫酸恰好完全反應.過濾后所得溶液的質量為108g,(不考慮過濾過程中溶液的質量損失).
(1)混合物中銅元素的質量分數為 (計算結果保留到0.1%)
(2)求稀硫酸中H2SO4的質量分數.(寫出計算過程)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
將148g氯化鈣溶液與一定量的碳酸鈉溶液混合,恰好完全反應.過濾后,得到20g沉淀和溶質質量分數10%的溶液.求:碳酸鈉溶液中溶質質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
實驗室有瓶存放一段時間的氫氧化鈉固體,部分已變質為碳酸鈉.取2.00g該固體,先加水充分溶解,再加入足量澄清石灰水,生成1.00g碳酸鈣沉淀.計算:
(1)2.00g該固體中碳酸鈉的質量;
(2)該氫氧化鈉固體的變質程度.(計算結果保留到1%)
(提示:氫氧化鈉的變質程度是指已變質的氫氧化鈉占變質前氫氧化鈉的質量分數)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
一瓶久置的氫氧化鈉固體已經發生了變質,某研究小組為了探究氫氧化鈉的變質純度,作出如下猜想:猜想一、可能部分變質,固體是NaOH和Na2CO3的混合物;猜想二、可能全部變質,固體是Na2CO3。
(1)首先對固體的成分進行確定。取少量固體于試管中,加水充分溶解,先加入足量的BaCl2溶液,產生白色沉淀,靜置后取上層溶液,再加入CuSO4溶液,產生藍色絮狀沉淀。根據實驗現象,可判斷 是正確的。
(2)稱取10.6克該固體樣品于錐形瓶中,加入一定質量分數的稀鹽酸,直至過量,得到數據如下表:
| 樣品質量 | 反應前總質量 | 反應后總質量 |
| 10.6克 | 148.5克 | 146.3克 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com