
【題目】在100℃時,把0.5mol N2O4通入體積為5L的真空密閉容器中,立即出現紅棕色.反應進行到2s時,NO2的濃度為0.02molL﹣1 . 在60s時,體系已達平衡,此時容器內壓強為開始時的1.6倍.請回答下列問題:
(1)前2s以N2O4的濃度變化表示的平均反應速率為;
(2)平衡時,NO2的體積分數為;
(3)平衡時,N2O4的轉化率為;
(4)平衡時,混合氣體的平均摩爾質量為 .
【答案】
(1)0.005mol?L﹣1s﹣1
(2)75%
(3)60%
(4)57.5g?mol﹣1
【解析】解:2秒時,NO2的濃度為0.02摩/升,則轉化的N2O4的濃度為0.01mol/L,則前2秒,以N2O4的濃度變化表示的平均反應速度;
依據化學平衡三段式列式計算,反應進行到60s時,體系已達平衡,此時容器內壓強為開始時的1.6倍,設消耗N2O4的物質的量為x,列式計算
N2O4 | ═ | 2NO2 | |
起始量(mol) | 0.5 | 0 | |
變化量(mol) | x | 2x | |
平衡量(mol) | 0.5﹣x | 2x |
0.5﹣x+2x=0.5×1.6
x=0.3mol
(1.)2秒時,NO2的濃度為0.02摩/升,則轉化的N2O4的濃度為0.01mol/L,則前2秒,以N2O4的濃度變化表示的平均反應速度為 ![]() =0.005mol/L.s;所以答案是:0.005mol/L.s;
=0.005mol/L.s;所以答案是:0.005mol/L.s;
(2.)平衡時,NO2的體積分數= ![]() ×100%=
×100%= ![]() ×100%=75%;所以答案是:75%;
×100%=75%;所以答案是:75%;
(3.)平衡時,N2O4的轉化率= ![]() ×100%=60%;所以答案是:60%;
×100%=60%;所以答案是:60%;
(4.)平衡時,混合氣體的平均摩爾質量= ![]() =
= ![]() =57.5g/mol;
=57.5g/mol;
所以答案是:57.5gmol﹣1;
【考點精析】解答此題的關鍵在于理解化學平衡的計算的相關知識,掌握反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】可逆反應:3A(g)![]() 3B(?)+C(?)△H>0,隨著溫度升高,氣體平均相對分子質量有變小趨勢,則下列判斷正確的是( )
3B(?)+C(?)△H>0,隨著溫度升高,氣體平均相對分子質量有變小趨勢,則下列判斷正確的是( )
A. B和C可能都是固體 B. 若C為固體,則B一定是氣體
C. B和C一定都是氣體 D. B和C不可能都是氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知3.01×1023個X2氣體分子的質量為16g,則X的相對原子質量是( )
A. 16 B. 32 C. 64g /mol D. 32g /mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列裝置說法正確的是( )
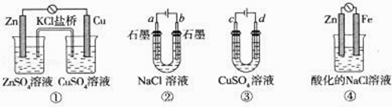
A. 裝置①中,鹽橋中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的裝置②在電解過程中,b極先變紅
C. 可以用裝置③在鐵上鍍銅,d極為銅
D. 裝置④中發生鐵的吸氧腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各式中屬于正確的水解反應離子方程式的是( )
A.NH4++H2ONH3·H2O+H+B.S2-+2H2OH2S+2OH-
C.CH3COOH+H2OCH3COO-+H3O+D.CH3COOH+OH-CH3COO-+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A,B,C均為短周期元素,它們在周期表中的位置如圖所示.已知:B,C兩元素原子最外層電子數之和等于A元素原子最外層電子數的2倍;B,C兩元素的核電荷數之和是A元素原子序數的4倍.則A,B,C分別是( ) 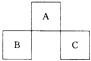
A.C,Al,P
B.N,Si,S
C.0,P,Cl
D.F,S,Ar
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含 S2-、 Fe2+、 Br -、 I-各 0.1 mol 的溶液中通入 Cl2, 通入 Cl2 的體積(標準狀況) 和溶液中相關離子的物質的量的關系圖正確的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列與有機物的結構、性質的有關敘述中正確的是( )
A.乙酸與乙醇可以發生酯化反應,又均可與金屬鈉發生反應
B.乙烯、聚乙烯均可使酸性高錳酸鉀溶液褪色
C.分餾、干餾都是物理變化,裂化、裂解都是化學變化
D.石油經過分餾得到多種烴,煤經過分餾可制得焦炭、煤焦油等產品
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com