
【題目】下列熱化學方程式書寫正確的是
A. 2SO2 + O2![]() 2SO3 △H=-196.6 kJ·mol-1
2SO3 △H=-196.6 kJ·mol-1
B. C(s) + O2(g) = CO2(g) △H=393.5 kJ·mol-1
C. H+(aq) + OH-(aq) = H2O(l) △H=57.3 kJ
D. ![]() H2(g) +
H2(g) + ![]() Cl2(g) = HCl(g) △H=-92.5 kJ·mol-1
Cl2(g) = HCl(g) △H=-92.5 kJ·mol-1
 培優三好生系列答案
培優三好生系列答案 優化作業上海科技文獻出版社系列答案
優化作業上海科技文獻出版社系列答案科目:高中化學 來源: 題型:
【題目】金屬釩主要用于冶煉特種鋼, 被譽為 “合金的維生素”。工業上常用富釩爐渣 (主要含FeO·V2O3, 還有少量P2O5等雜質) 制取釩的流程如下圖。
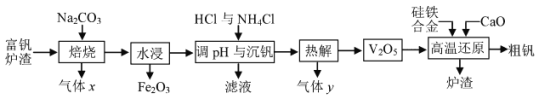
回答下列問題:
(1)已知焙燒中先發生4FeO·V2O3+5O2![]() 4V2O5+2Fe2O3反應, 其氧化產物是__,進一步生成可溶性NaVO3的反應方程式為______。
4V2O5+2Fe2O3反應, 其氧化產物是__,進一步生成可溶性NaVO3的反應方程式為______。
(2)25℃時,Ksp(NH4VO3)=4×10-2,電離平衡常數Kb(NH3·H2O) =1.8×10-5。“沉釩” 后VO3-的濃度為![]() mol/L,則濾液的pH為___。除OH-與VO3-外,濾液中還可能存在的陰離子是__。
mol/L,則濾液的pH為___。除OH-與VO3-外,濾液中還可能存在的陰離子是__。
(3) “熱解” 過程產生的氣體 y的電子式為__。
(4)硅參與高溫還原反應的方程式為_____,爐渣的主要成分是__。
(5)釩比鐵的金屬性強。工業上通過電解精煉 “粗釩” 可得到99.5%的純釩, 以熔融LiCl-KCl-VCl2為電解質,“粗釩” 中含少量鐵和硅。則 “粗釩” 應連接電源的___極, 陰極的電極反應式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】117號元素Ts的原子最外層電子數是7,下列說法不正確的是
A.Ts是第七周期第ⅦA族元素B.還原性:I<Ts
C.原子半徑:I<TsD.中子數為176的Ts的核素符號:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4—CO2催化重整可以得到合成氣(CO和H2),有利于減小溫室效應,其主要反應為CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同時存在以下反應:積碳反應:CH4(g) C(s) +2H2(g) ΔH=+75 kJ·mol1;消碳反應:CO2(g) +C(s) 2CO(g) ΔH=+172 kJ·mol1,積碳會影響催化劑的活性,一定時間內積碳量和反應溫度的關系如下圖。

下列說法正確的是
A.高壓利于提高CH4的平衡轉化率并減少積碳
B.增大CO2與CH4的物質的量之比有助于減少積碳
C.溫度高于600℃,積碳反應的化學反應速率減慢,消碳反應的化學反應速率加快,積碳量減少
D.升高溫度,積碳反應的化學平衡常數K減小,消碳反應的K增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下鋁粉與氧化鐵的反應可以用來焊接鋼軌,該反應會放出大量的熱,使置換出的鐵呈熔融態,從而達到焊接目的。下列分析錯誤的是
A.該反應不屬于氧化還原反應
B.被還原的物質是氧化鐵
C.該反應的還原劑是鋁粉
D.該反應可以用來冶煉某些熔點高的金屬
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下的定容容器中,當下列哪些物理量不再發生變化時,表明反應A(g)+2B(g) ![]() C(g)+D(g)已達到平衡狀態的是
C(g)+D(g)已達到平衡狀態的是
①混合氣體的壓強 ②混合氣體的密度 ③B的物質的量濃度 ④混合氣體總物質的量 ⑤混合氣體的平均相對分子質量 ⑥v(C)與v(D)的比值為1:1 ⑦混合氣體總質量 ⑧混合氣體總體積
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在容積為10 L的固定容器中發生反應:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反應過程如下圖。下列說法正確的是
2NH3(g) ΔH<0,反應過程如下圖。下列說法正確的是
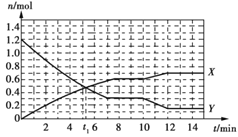
A. t1 min時,正、逆反應速率相等
B. 曲線X表示NH3的物質的量隨時間變化的關系
C. 0~8 min,H2的化學反應速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的化學反應速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
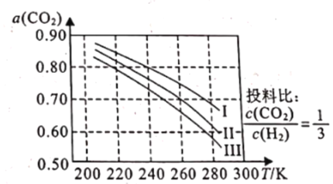
【題目】將CO2應用于生產清潔燃料甲醇,既能緩解溫室效應的影響,又能為能源的制備開辟新的渠道,其合成反應為CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列問題:
CH3OH(g)+H2O(g)。回答下列問題:
(1)如圖為CO2平衡轉化率和溫度、壓強的關系,其中壓強分別為3.0MPa、4.0MPa和5.0MPa。據圖可知,該反應為_______________反應(填“放熱”或“吸熱")。設CO2的初始濃度為comolL-1,根據5.0MPa時的數據計算該反應的平衡常數K(240k)=_______________ (列出計算式即可)。若在4.0MPa時減小投料比,則CO2的平衡轉化率曲線可能位于II線的_______________(填“上方”或“下方”)。
(2)利用二氧化碳制得的甲醇還可以制取甲胺,其反應原理為CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知該反應中相關化學鍵的鍵能數據如下:
CH3NH2(g)+H2O(g)△H。已知該反應中相關化學鍵的鍵能數據如下:
共價鍵 | C—O | H—O | N—H | C—N |
鍵能/k.Jmol-1 | 351 | 463 | 393 | 293 |
則該反應的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
則:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定溫度下,下列措施一定能加快反應CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填選項字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填選項字母)。
A.及時移去甲醇 B.改進催化劑 C.提高反應物濃度 D.增大容器壓強
(5)甲烷重整可選氧化物NiO- Al2O3作為催化劑,工業上常用Ni(NO3)2、Al(NO3)3混合液加入氨水調節pH=12(常溫),然后將濁液高壓恒溫放置及煅燒等操作制備該催化劑。加入氨水調節pH=12時,c(Ni2+)為_______________。[已知:Ksp[Ni(OH)2]=5×10-16]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵晶體(FeSO4·7H2O)在醫藥上作補血劑。某課外小組測定該補血劑中鐵元素的含量。實驗步驟如下:請回答下列問題:
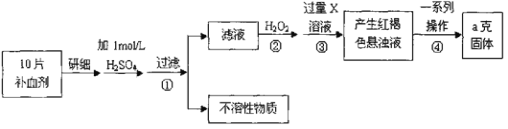
(1)實驗中碾碎藥片需要的儀器是_____________。
A.燒杯 B.研缽 C.坩堝
(2)證明步驟①濾液中含有Fe2+的方法是先滴加KSCN溶液,再滴加____________,該過程的現象為:__________________________________________________________。
(3)步驟②加入過量H2O2的目的:________________________________________。
(4)步驟②③中反應的離子方程式:②________________、③_________________。
(5)步驟④中一系列處理的操作步驟:過濾、___、灼燒、____、稱量。
(6)若實驗無損耗,則每片補血劑含鐵元素的質量_____________g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com