
決定化學反應速率的根本因素是
| A.溫度和壓強 | B.反應物的濃度 |
| C.物質自身的性質 | D.催化劑的加入 |
 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:單選題
反應4A(g)+5B(g)="=" 4C(g)+ 6D(g)在某密閉容器中進行,半分鐘后,C的物質的量濃度增加了0.3mol/L。下列論述正確的是( )
A.半分鐘內的平均反應速率:5v(B)=6v(D) B.C的平均反應速率是0.010 mol·L-1·s-1
C.容器中含D的物質的量至少為0.45mol D.容器中A的物質的量濃度增加了0.3mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
對反應A+B AB來說,常溫下按以下情況進行反應:
AB來說,常溫下按以下情況進行反應:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反應速率的大小關系是 ( )
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在體積為2 L的恒容密閉容器中發生反應xA(g)+yB(g) zC(g),圖I表示200℃時容器中A、B、C物質的量隨時間的變化,圖Ⅱ表示不同溫度下平衡時C的體積分數隨起始n(A):n(B)的變化關系。則下列結論正確的是 ( )
zC(g),圖I表示200℃時容器中A、B、C物質的量隨時間的變化,圖Ⅱ表示不同溫度下平衡時C的體積分數隨起始n(A):n(B)的變化關系。則下列結論正確的是 ( )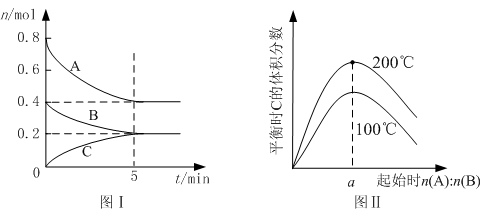
A.200℃時,反應從開始到平衡的平均速率v(B)=" 0." 04 mol·L-1·min-1
B.圖Ⅱ所知反應xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在圖Ⅰ所示的平衡狀態下,再向體系中充入He,重新達到平衡前v(正)>v(逆)
D.200℃時向容器中再充入2 mol A 和1 mol B,達到平衡,A 的體積分數小于0.5
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
(6分)按要求回答下列問題
(1)把鋅片投入到盛有鹽酸的敞口容器中,產生H2的速率可由圖⑴表示。
在下列因素中對產生H2速率有影響的是 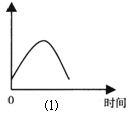
①鹽酸的濃度 ②鋅片的表面積 ③溶液的溫度 ④Cl-的濃度
| A.①④ | B.③④ | C.①②③ | D.②③ |

查看答案和解析>>
科目:高中化學 來源: 題型:單選題
2SO2+O2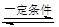 2SO3是工業上制硫酸的反應。下列關于該反應的說法正確的是( )
2SO3是工業上制硫酸的反應。下列關于該反應的說法正確的是( )
| A.減少O2的濃度能加快反應速率 |
| B.降低體系溫度能加快反應速率 |
| C.使用催化劑不影響反應速率 |
| D.一定條件下達到反應限度時SO2部分轉化為SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在25 ℃時,密閉容器中X、Y、Z三種氣體的濃度變化情況如圖,下列說法錯誤的是
A.反應可表示為3X+Y 2Z 2Z |
| B.從反應開始到0.4 s時,以Y表示的化學反應速率為0.25 mol·L-1·s-1 |
| C.增大壓強使平衡向生成Z的方向移動,正逆反應速率均增大 |
| D.升高溫度,平衡常數一定增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在673K、30MPa下,在密閉容器中進行合成氨反應: N2(g)+3H2(g) 2NH3(g) △H<0,n(NH3)和n(H2)隨時間(t)的變化關系如右圖所示。下列分析一定正確的是
2NH3(g) △H<0,n(NH3)和n(H2)隨時間(t)的變化關系如右圖所示。下列分析一定正確的是
| A.正反應速率:a點小于b點 |
| B.c點處反應達到平衡 |
| C.d點和e點處的n(N2)不一樣 |
| D.若其他條件不變,在773 K時反應至t1時刻,n(H2)比圖中d點對應的n(H2)大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
CaCO3與稀鹽酸反應(放熱反應)生成CO2的量與反應時間的關系如圖所示。下列結論不正確的是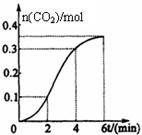
| A.反應開始2分鐘內平均反應速率最大 |
| B.反應4分鐘后平均反應速率最小 |
| C.反應開始4分鐘內溫度對反應速率的影響比濃度大 |
| D.反應4分鐘后反應速率下降的原因是鹽酸濃度逐漸減小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com