
【題目】有部分元素的性質與原子(或分子)結構如下表,根據信息回答下列問題:
元素編號 | 元素性質與原子(或分子)結構 |
T | 最外層電子數是次外層電子數的3倍 |
X | 其氣態氫化物與最高價氧化物對應的水化物能起化合反應 |
Y | M層比K層少1個電子 |
Z | 第三周期元素的簡單離子中半徑最小 |
W | L層電子數是K層和M層電子數之和 |
(1)寫出元素X形成的單質的電子式:__________;
(2)元素Y與元素Z相比,金屬性較強的是________(用元素符號表示),下列表述中能證明這一事實的是________(填序號)。
a.Y單質的熔點比Z單質低 b.Y的化合價比Z低
c.Y單質與水反應比Z單質劇烈 d.Y最高價氧化物對應的水化物的堿性比Z強
(3)元素T與元素W相比,非金屬性較強的是________(用元素符號表示),寫出一個能表示T、W非金屬性強弱關系的化學反應方程式 。
(4)寫出T與Y形成的化合物的化學式__________,__________。
(5)元素T和氫元素以原子個數比1∶1化合形成化合物P,元素X與氫元素以原子個數比1∶2化合形成常用作火箭燃料的化合物Q,P與Q發生氧化還原反應,生成X單質和T的另一種氫化物,寫出該反應的化學方程式:_____________________________。
【答案】(1)![]() (2)Na;cd (3)O;2H2S+O2=2S+2H2O (4)Na2O、Na2O2
(2)Na;cd (3)O;2H2S+O2=2S+2H2O (4)Na2O、Na2O2
(5)N2H4+2H2O2=N2+4H2O
【解析】試題分析:T最外層電子數是次外層電子數的3倍,則T只能是第二周期元素,所以T是O;X的氣態氫化物與最高價氧化物對應的水化物能起化合反應,因此X是N;Y的M層比K層少1個電子,則Y的族序數是11,即Y是Na;Z是第三周期元素的簡單離子中半徑最小,所以Z是Al;W的L層電子數是K層和M層電子數之和,則M層是8-2=6,因此W是S。
(1)氮氣的電子式為![]() ;
;
(2)a.金屬性強弱與單質的熔沸點沒有關系,a錯誤;b.金屬性強弱與化合價沒有關系,b錯誤;c.鈉單質與水反應比鋁單質劇烈,說明金屬性鈉強于鋁,c正確;d.金屬性越強,最高價氧化物水化物的堿性越強,則Y最高價氧化物對應的水化物的堿性比Z強說明金屬性鈉強于鋁,d正確,答案選cd。
(3)同主族自上而下非金屬性逐漸減弱,則氧元素的非金屬性強于硫。能表示二者非金屬性強弱關系的化學反應方程式可以是2H2S+O2=2S+2H2O。
(4)O與Na形成的化合物的化學式Na2O、Na2O2。
(5)元素T和氫元素以原子個數比1∶1化合形成化合物P,P是雙氧水。元素X與氫元素以原子個數比1∶2化合形成常用作火箭燃料的化合物Q,則Q是N2H4,二者發生氧化還原反應,生成氮氣和水,則該反應的化學方程式為N2H4+2H2O2=N2+4H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】一定溫度下,向容積為2L的密閉容器中通入兩種氣體發生化學反應,反應中各物質的物質的量變化如圖所示,對該反應的推斷合理的是

A.該反應的化學方程式為3B+2D 6A+4C
B.反應進行到1 s時,v(A)=3v(D)
C.反應進行到6 s時,B的平均反應速率為0.1mol/(Ls)
D.反應進行到6 s時,各物質的反應速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作中錯誤的是( )
A.除去乙酸乙酯中的少量乙酸:加入飽和Na2CO3溶液,分液
B.除去Fe2O3中的少量Al2O3:加入過量NaOH溶液,過濾,洗滌干燥
C.除去氯氣中的少量氯化氫:通過盛有飽和食鹽水溶液的洗氣瓶
D.提取溶解在水中的少量碘:加入酒精,振蕩、靜置分層后,取出有機層再分離
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分類法是一種行之有效、簡單易行的科學方法。某同學用下表所示形式對所學知識進行分類,其中甲與乙、丙、丁是包含關系。下列各組中,正確的組合是( )
選項 | 甲 | 乙、丙、丁 |
A | 純凈物 | 液氯、水玻璃、明礬 |
B | 非電解質 | 冰醋酸、SO2、乙醇 |
C | 弱電解質 | CH3COOH 、氨水、H2O |
D | 堿性氧化物 | CaO、Na2O、K2O |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某市場銷售的某種食用精制鹽包裝袋上有如下說明:
產品標準 | GB5461 |
產品等級 | 一級 |
配料 | 食鹽、碘酸鉀、抗結劑 |
碘含量(以I計) | 20~50 mg/kg |
分裝日期 | |
分裝企業 |
(1)I2可用四氯化碳檢驗。向碘的四氯化碳溶液中加入Na2SO3稀溶液,將I2還原,以回收四氯化碳。
①Na2SO3稀溶液與I2反應的離子方程式是:________________________________________________。
②某學生設計回收四氯化碳的操作步驟為:
a.將碘的四氯化碳溶液置于分液漏斗中;
b.加入適量Na2SO3稀溶液;
c.分離出下層液體。
以上設計中遺漏的操作及在上述步驟中的位置是____________________________________________。
(2)已知:I2+2S2O32-===2I-+S4O62-。
某學生測定食用精制鹽的碘含量,其步驟為:
a.準確稱取w g食鹽,加適量蒸餾水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3與KI反應完全;
c.以淀粉溶液為指示劑,逐滴加入物質的量濃度為2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反應完全。
①判斷c中反應恰好完全依據的現象是________________________。
②b中反應所產生的I2的物質的量是______________mol。
③根據以上實驗和包裝袋說明,所測精制鹽的碘含量是(以含w的代數式表示)____________mg/kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:Fe(OH)3和Al(OH)3沉淀的生成與溶解的pH如下表。
氫氧化物 | 溶液pH | |||
開始沉淀 | 沉淀完全 | 沉淀開始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | —— | —— |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情況如下圖所示。以下推斷錯誤的是
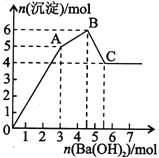
A.AB段可能發生的反應:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C點對應的沉淀:Fe(OH)3和BaSO4
C.OA段可能發生的反應:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.據圖計算原溶液中:c(Cl-)=c(SO42-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】提純下列物質所選用的除雜質試劑與主要分離方法都正確的是(括號內為少量雜質),
不純物質 | 除雜試劑 | 分離方法 | |
A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 過濾 |
C | 乙酸乙酯(乙酸) | KOH溶液 | 分液 |
D | 苯(苯酚) | 濃Br2水 | 過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖裝置,進行NH3與金屬氧化物MxOy反應生成M、N2、H2O,通過測量生成水的質量來測定M的相對原子質量。a中試劑是濃氨水。
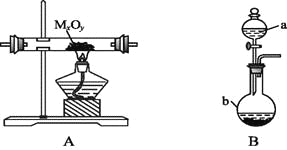
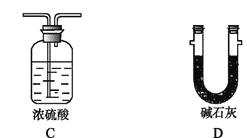
(1)儀器a的名稱為 ,儀器b中裝入的試劑可以是 。
(2)按氣流方向正確的裝置連接順序為(填序號,裝置可重復使用): 。
(3)裝置C的作用: 。
(4)實驗結束時,應首先 (填序號); 這樣做的原因是 。
Ⅰ.熄滅A裝置的酒精燈 Ⅱ.停止從a中滴加液體
(5)若金屬氧化物為CuO,反應的化學方程式為 。
(6)若實驗中準確稱取金屬氧化物的質量為mg,完全反應后,測得生成水的質量為ng,則M的相對原子質量為 (用含x、y、m、n的式子表示)。
(7)某同學仔細分析上述裝置后認為仍存在缺陷,你認為該如何改進? 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com