
【題目】H(3-溴-5-甲氧基苯甲酸甲酯)是重要的有機物中間體,可以由A(C7H8)通過下圖路線合成。

請回答下列問題:
(1)C的化學名稱為________,G中所含的官能團有醚鍵、_______(填名稱)。
(2)B的結構簡式為________,B生成C的反應類型為___________。
(3)由G生成H的化學方程式為___________。
(4)化合物F的同分異構體中能同時滿足下列條件的共有________種。
①氨基和羥基直接連在苯環上 ②苯環上有三個取代基且能發生水解反應
(5)設計用對硝基乙苯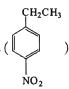 為起始原料制備化合物
為起始原料制備化合物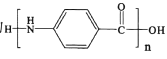 的合成路線(其他試劑任選)。_________________________
的合成路線(其他試劑任選)。_________________________
【答案】3,5-二硝基苯甲酸 羧基、溴原子 ![]() 取代反應
取代反應 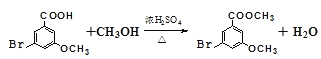 30
30 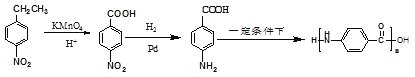
【解析】
A發生氧化反應生成B,B發生取代反應生成C,根據C結構簡式及A分子式知,A為![]() 、B為
、B為![]() ,根據E結構簡式知,E→F是用“H2/Pd”將硝基轉化為氨基,而C→D選用的是(NH4)2S,則D為
,根據E結構簡式知,E→F是用“H2/Pd”將硝基轉化為氨基,而C→D選用的是(NH4)2S,則D為 ,D發生取代反應生成E,E發生還原反應生成F,F發生取代反應生成G,G發生酯化反應生成H,H為
,D發生取代反應生成E,E發生還原反應生成F,F發生取代反應生成G,G發生酯化反應生成H,H為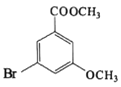 ;
;
(5)用對硝基乙苯(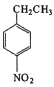 )為起始原料制備化合物
)為起始原料制備化合物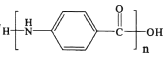 ,乙苯被酸性高錳酸鉀溶液氧化生成對硝基苯甲酸,然后發生還原反應生成對氨基苯甲酸,最后發生縮聚反應生成目標產物。
,乙苯被酸性高錳酸鉀溶液氧化生成對硝基苯甲酸,然后發生還原反應生成對氨基苯甲酸,最后發生縮聚反應生成目標產物。
(1)根據C的結構簡式可知:C的化學名稱為3,5-二硝基苯甲酸,G中所含的官能團有醚鍵、溴原子、羧基;
(2)B的結構簡式為![]() ,B生成C的反應類型為取代反應;
,B生成C的反應類型為取代反應;
(3)G和甲醇發生酯化反應生成H,由G生成H的化學方程式為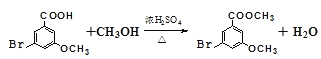 ;
;
(4)化合物F的同分異構體中能同時滿足下列條件:
①氨基和羥基直接連在苯環上;
②苯環上有三個取代基且能發生水解反應,說明含有酯基;
如果取代基為-NH2、-OH、CH3COO-,有10種;
如果取代基為-NH2、-OH、HCOOCH2-,有10種;
如果取代基為-NH2、-OH、-COOCH3,有10種;
所以符合條件的有3×10=30種;
(5)用對硝基乙苯( )為起始原料制備化合物
)為起始原料制備化合物 ,對硝基乙苯的乙基被酸性高錳酸鉀溶液氧化為羧基-COOH,反應生成對硝基苯甲酸
,對硝基乙苯的乙基被酸性高錳酸鉀溶液氧化為羧基-COOH,反應生成對硝基苯甲酸![]() ,然后
,然后![]() 再發生還原反應生成對氨基苯甲酸
再發生還原反應生成對氨基苯甲酸![]() ,最后
,最后![]() 發生縮聚反應生成目標產物
發生縮聚反應生成目標產物 ,故其合成路線為:
,故其合成路線為: 。
。


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:
【題目】普伐他汀是一種調節血脂的藥物,其結構如右圖所示(未表示出其空間構型)。下列關于普伐他汀的性質描述正確的是
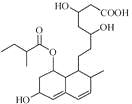
A. 能與FeCl3溶液發生顯色反應
B. 能使酸性KMnO4溶液褪色
C. 1mol該物質與足量鈉發生反應生成4molH2
D. 1mol該物質最多可與1molNaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在如圖所示裝置中進行氨的催化氧化實驗:往三頸瓶內的濃氨水中不斷通入空氣,將紅熱的鉑絲插入瓶中并接近液面。反應過程中,可觀察到瓶中有紅棕色氣體產生,鉑絲始終保持紅熱。下列有關說法錯誤的是( )

A. 反應后溶液中含有NO3-
B. 反應后溶液中c(H+)增大
C. 實驗過程中有化合反應發生
D. 實驗過程中NH3H2O的電離常數不可能發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Garnet型固態電解質被認為是鋰電池最佳性能固態電解質。LiLaZrTaO材料是目前能夠達到最高電導率的Garnet型電解質。某Garnet型鋰電池工作原理如圖所示,電池工作反應原理為:C6Lix+Li1xLaZrTaO=LiLaZrTaO+C6。下列說法不正確的是( )
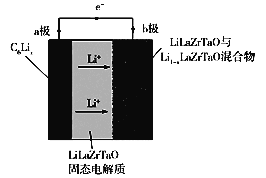
A.b極為正極,a極發生氧化反應
B.LiLaZrTaO固態電解質起到傳導Li+的作用
C.b極反應為:xLi++Li1xLaZrTaOxe=LiLaZrTaO
D.當電池工作時,每轉移x mol電子,b極增重7x g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L恒容密閉容器中投入足量M(s)和一定量的R(g),發生反應為M(s)+R(g)![]() X(g)+Y(g) △H;所得實驗數據如表所示:
X(g)+Y(g) △H;所得實驗數據如表所示:
實驗 | 溫度/℃ | 起始時R的物質的量/mol | 平衡時氣體總物質的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推斷正確的是( )
A.上述反應中,△H<0
B.實驗②中,該反應的平衡常數K=0.5
C.實驗①經4min達到平衡,0~4 min內υ(X)=0.2mol·L-1·min-1
D.實驗③中a=6.00
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A. 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 與Al反應能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水電離的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲線如圖所示。下列有關描述錯誤的是
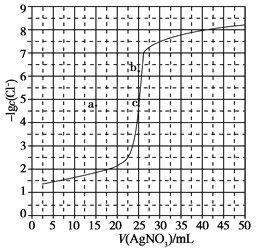
A. 根據曲線數據計算可知Ksp(AgCl)的數量級為10-10
B. 曲線上各點的溶液滿足關系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同實驗條件下,若改為0.0400 mol·L-1 Cl-,反應終點c移到a
D. 相同實驗條件下,若改為0.0500 mol·L-1 Br-,反應終點c向b方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦化合物常見價態有+2和+4。鈦白粉(TiO2,兩性氧化物)用途廣泛。工業上由高鈦渣(主要成分為Ti3O5,還含有TiO2、Fe2O3等)制取鈦白粉的主要工藝過程如下:
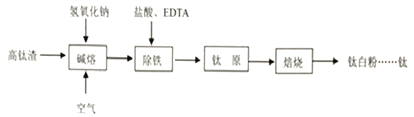
(1)寫出堿熔步驟所發生反應的化學方程式____________、____________。
(2)實驗測定EDTA加入量(EDTA和Fe3+的物質的量之比)對 Ti4+和Fe3+溶出率的影響如圖所示。由圖可知,EDTA的加入量為____________時除鐵效率最佳,理由是____________。

(3)在實驗室模擬除鐵凈化后的實驗步驟:①向鈦原料中加入稀硫酸生成偏鈦酸(H2TiO3)沉淀,反應結束后過濾;②洗滌;③……;④在650℃下高溫焙燒得到較純的鈦白粉固體。步驟③的實驗目的是____________,需要用到的試劑有____________。
(4)測定鈦白粉純度:稱取試樣0.200g在CO2氣氛下用金屬鋁將鈦(IV)還原成鈦(Ⅲ),還原后的溶液以NH4SCN為指示劑,用0.08mol/L的 NH4Fe(SO4)2標準液滴定,滴定終點時消耗標準液29.20mL,鈦白粉的純度為____________。(保留三位有效數字)
(5)最新研究發現也可以用圖示裝置由TiO2獲得金屬鈦。裝置中陽極的電極反應方程式為____________,在制備金屬鈦前后,整套裝置中CaO的總量____________(填寫“增大”、“減小”或者“不變”)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于說法正確的是
A. HCl和NaOH反應的中和熱為57.3kJ/mol,H2SO4和Ba(OH)2反應的中和熱也為57.3kJ/mol
B. 已知C2H5OH(l)的燃燒熱是1366.8kUmol,則C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)反應的△H=-1366.8kJ/mol
C. 一定溫度和壓強下,將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3(g),放出熱量19.3kJ.則其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
D. 一定條件下2SO2(g)+O2(g)![]() 2SO3(g)△H1 2SO2(g)+O2(g)
2SO3(g)△H1 2SO2(g)+O2(g)![]() 2SO3(l)△H2則△H1>△H2
2SO3(l)△H2則△H1>△H2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com