
【題目】一種氣態烷烴和一種氣態烯烴組成的混合物共10g,混合氣體的密度是相同狀況下氫氣的12.5倍,該混合氣體通過溴水時,溴水的質量增加8.4g。則該烷烴的分子為______________,該烯烴的結構簡式為____________,烷烴和烯烴的體積比為:________________。
【答案】CH4 CH2=CH2 1:3
【解析】
根據相對密度=![]() 可計算出混合氣體的平均相對分子質量,結合常見有機物的相對分子質量判斷一定含有甲烷,根據氣體的質量、摩爾質量計算混合氣體的物質的量,根據混合氣通過Br2水時增加的質量為烯烴的質量,可得甲烷的質量,再利用n=
可計算出混合氣體的平均相對分子質量,結合常見有機物的相對分子質量判斷一定含有甲烷,根據氣體的質量、摩爾質量計算混合氣體的物質的量,根據混合氣通過Br2水時增加的質量為烯烴的質量,可得甲烷的質量,再利用n=![]() 計算出甲烷的物質的量,進而可得烯烴的物質的量,利用n=
計算出甲烷的物質的量,進而可得烯烴的物質的量,利用n=![]() 計算烯烴的摩爾質量,可得其分子式和結構簡式,利用n=
計算烯烴的摩爾質量,可得其分子式和結構簡式,利用n=![]() 關系得到甲烷與烯烴的體積比。
關系得到甲烷與烯烴的體積比。
(1)混合氣體的密度是相同狀況下H2密度的12.5倍,所以混合物的平均摩爾質量為12.5×2g/mol=25g/mol,相對分子質量小于25的只有甲烷,所以混合氣體中一定有甲烷,混合氣體的總的物質的量為:n(總)=![]() =0.4mol,該混合氣通過Br2水時,Br2水增重8.4g,8.4g為烯烴的質量,則甲烷的質量為10g-8.4g=1.6g,則甲烷的物質的量為n(CH4)=
=0.4mol,該混合氣通過Br2水時,Br2水增重8.4g,8.4g為烯烴的質量,則甲烷的質量為10g-8.4g=1.6g,則甲烷的物質的量為n(CH4)=![]() =0.1mol,因此烯烴的物質的量為:0.4mol-0.1mol=0.3mol,烯烴的摩爾質量為M(烯)=
=0.1mol,因此烯烴的物質的量為:0.4mol-0.1mol=0.3mol,烯烴的摩爾質量為M(烯)=![]() g/mol,相對分子質量是28,根據烯烴的分子式通式CnH2n=28,可得n=2,所以該烯烴為乙烯CH2=CH2,所以烷烴與烯烴的體積比為:0.1:0.3=1:3。
g/mol,相對分子質量是28,根據烯烴的分子式通式CnH2n=28,可得n=2,所以該烯烴為乙烯CH2=CH2,所以烷烴與烯烴的體積比為:0.1:0.3=1:3。


科目:高中化學 來源: 題型:
【題目】由下列實驗及現象能推出相應結論的是
實驗 | 現象 | 結論 | |
A | 將硝酸亞鐵樣品溶于稀硫酸,滴加KSCN溶液 | 溶液變為紅色 | 硝酸亞鐵樣品已氧化變質 |
B | 向硅酸鈉溶液中通入CO2 | 產生白色沉淀 | 非金屬性:C>Si |
C | 向盛有FeS固體的燒杯中滴加鹽酸,并產生氣體通入溴水中 | 溴水褪色 | 還原性:S2->Br->Cl- |
D | 向無色溶液中滴入氯化鋇溶液和稀硝酸 | 有白色沉淀產生 | 無色溶液中一定含有SO42-或SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學家們合成了如圖所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列說法正確的是



三星烷 四星烷 五星烷
A. 它們之間互為同系物
B. 六星烷的化學式為C18H24
C. 三星烷與丙苯互為同分異構體,四星烷與![]() 互為同分異構體
互為同分異構體
D. 它們的一氯代物均只有兩種,而三星烷的二氯代物有四種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄酒中常加入亞硫酸鹽作為食品添加劑,為檢測某葡萄酒樣品中亞硫酸鹽的含量(通常以酒樣中SO2的量計),某研究小組設計了如下實驗(已知還原性:SO32->I->Cl-)。下列說法不正確的是
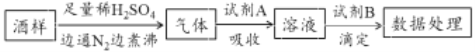
A. 葡萄酒中加亞硫酸鹽的主要目的是防止氧化,利用了亞硫酸鹽的還原性
B. 通入N2和煮沸的目的是為了將產生的氣體從溶液中全部趕出
C. 若試劑A選擇氯水,則試劑B可選擇NaOH標準液
D. 若試劑A選擇堿液,調節吸收后溶液為中性,則試劑B可選擇I2標準液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~G是幾種烴的分子球棍模型,據此回答下列問題:

(1)常溫下含碳量最高的氣態烴是________(填對應字母);
(2)能夠發生加成反應的烴有________種;
(3)G的一氯代物有________種;E的二氯代物有_________種;
(4)寫出C與溴的四氯化碳溶液反應的化學方程式______________________;
(5)寫出F與濃硝酸和濃硫酸反應的化學方程式________________________。反應類型為_______
現有上面A、B、C三種有機化合物:(以下均用結構簡式作答)
(6)同狀況、同體積的以上三種物質完全燃燒時耗去O2的量最多的是_____。
(7)等質量的以上三種物質燃燒時,生成二氧化碳最多的是__________,生成水最多的是__________。
(8)在120℃、1.01×105Pa時,有兩種氣態烴和足量的氧氣混合點燃,相同條件下測得反應前后氣體體積沒有發生變化,這兩種氣體是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗設計正確的是
A.將混有HC1氣體的CO2通入裝有飽和碳酸鈉溶液的洗氣瓶,可除去HC1
B.用向上排空氣法收集銅粉與稀硝酸反應產生的NO
C.將碘水倒入分液漏斗,加適量乙醇,振蕩后靜置,可將碘萃取到乙醇中
D.將SO2通入KMnO4酸性溶液證明SO2具有還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應6NO2+8NH3===7N2+12H2O構成電池的裝置如圖所示。此方法既能實現有效清除氮氧化物的排放,減輕環境污染,又能充分利用化學能。下列說法正確的是()

A. 電流從左側電極經過負載后流向右側電極
B. 為使電池持續放電,離子交換膜需選用陰離子交換膜
C. 電極A極反應式為2NH3-6e-===N2+6H+
D. 當有4.48 L NO2被處理時,轉移電子數為0.8NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水約占地球表面積的71%,具有十分巨大的開發潛力。下圖是開水資源綜合利用的工藝圖,以下說法正確( )

A. 電解NaCl溶液時可用鐵做電極,其離子方程式為:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦鹵中加入Cl2的作用是置換出溴單質,該過程體現了還原性:Cl- > Br-
C. 實驗室模擬海水提取淡水,除夾持裝置外只用到的儀器有蒸餾燒瓶、酒精燈、錐形瓶
D. Br2 與SO2的水溶液發生反應的離子方程式為:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某溫度下,在體積為5 L的容器中,A、B、C三種物質物質的量隨著時間變化的關系如圖所示,則該反應的化學方程式為__________,2 s內用A的濃度變化和用B的濃度變化表示的平均反應速率分別為________、________。

(2)把0.6 mol X氣體與0.6 mol Y氣體混合于2 L容器中發生反應:2X(g)+Y(g)=nZ(g)+2W(g),2 min末已生成0.2 mol W,若測得以v(Z)濃度變化表示的v(Z)=0.1 mol/(L·min)。求:
(1)n=_____?
(2)前2 min內,v(X)=_____?
(3)2 min末時Y的濃度_____?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com