
【題目】等物質的量的下列物質,在氧氣中充分燃燒,消耗氧氣的量最多的是( )
A.CH4B.C2H6C.C2H4D.C6H6
科目:高中化學 來源: 題型:
【題目】霧霾嚴重影響人們的生活與健康。某地區的霧霾中可能含有如下可溶性無機離子:
Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同學收集了該地區的霧霾,經必要的預處理后獲得試樣溶液,設計并完成了如下的實驗:

已知:3NO3-+8Al+5OH—+2H2O ![]() 3NH3↑+8A1O2—
3NH3↑+8A1O2—
根據以上的實驗操作與現象,該同學得出的結論正確的是
A. 不能確定試樣中是否含Al3+
B. 試樣中肯定存在NH4+、Mg2+和SO42-,其他離子都不能確定
C. 要確定試樣中是否有Na+存在,可做焰色反應實驗,若焰色為紫色,則存在Na+
D. 沉淀2只可能是碳酸鋇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗中,所選裝置或實驗設計合理的是
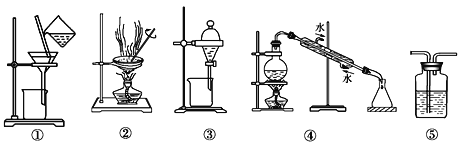
A. 圖⑤所示裝置中盛有飽和Na2SO3溶液除去SO2中含有的少量HCl
B. 用乙醇提取碘水中的碘選擇圖③所示裝置
C. 用圖①和②所示裝置進行粗鹽提純
D. 用圖④所示裝置進行石油分餾實驗制取汽油
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Mg、Al、Fe 三種金屬粉末狀混合物中,加人過量鹽酸充分反應,過濾后向濾液中加入過量NaOH溶液充分反應,再過濾后濾液中存在的離子有
A. Al3+ B. Cu2+ C. Mg2+ D. AlO2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.分散質微粒直徑介于1~10 nm之間的分散系稱為膠體
B.Fe(OH)3膠體是純凈物
C.利用丁達爾現象可以區別溶液與膠體
D.膠體微粒不能透過濾紙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X 、Y 、Z、W 、R 、M 、Q 是7種短周期元素,原子序數依次增大。已知X與其它6種元素不在同一周期,Y原子最外層電子數是次外層電子數的2倍,W是地殼中含量最多的元素,R、M、Q處于同一周期,R是該短周期中半徑最大的元素,M與W同一主族。請用化學用語回答下列問題:
(1)Y在周期表中的位置是________________;M、 W、R的簡單離子半徑大小順序為___________。(用離子符號表示)
(2)X、W、Q按照原子個數比1∶1∶1形成的化合物的電子式為_____________。
(3)W與R形成的化合物可作供氧劑,該化合物含有的化學鍵類型有:__________________________。
(4)M、Q的陰離子還原性較強的是:____________(用離子符號表示),用一個置換反應證實這一結論(寫化學方程式)____________________________________。
(5)以上幾種元素中,其中有一種元素的氣態氫化物可與它的最高價氧化物的水化物發生非氧化還原反應,請寫出反應的化學方程式:_____________________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學來源于生活又服務于生活,化工生產是指對原料進行化學加工,最終獲得有價值的產品的生產過程。某研究小組利用含硫酸亞鐵和硫酸銅的工業廢料制備鐵紅(氧化鐵)和硫酸銨晶體。流程如下:
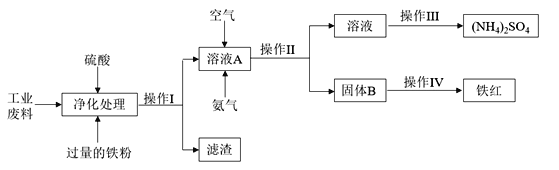
請回答下列問題:
(1)操作I的名稱________________,濾渣的成分為__________________。
(2)簡述下列實驗操作:
①檢驗溶液A中金屬陽離子的方法為____________________________________________________;
②檢驗固體B是否洗滌干凈的方法是____________________________________________________。
(3)請寫出溶液A中反應的離子方程式_______________________________________________________
(4) 測定廢料中硫酸銅的質量分數:稱取a g廢料樣品,將操作I得到的濾渣用足量的稀硫酸溶解、過濾、洗滌、干燥,稱得固體的質量為b g,則廢料中硫酸銅的質量分數為_______________(寫出表達式。)
(5) 某同學提出另一種制備鐵紅的方法:往工業廢水中加入足量的硫酸和雙氧水,通過下列操作也可以得到鐵紅,請配平下列離子方程式_____ Fe2++ _____ H2O2 + _____ H+= _____ Fe3+ + ____ H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將一定量的鈉鋁合金置于水中,合金全部溶解,得到20mL的溶液含NaOH 1mol/L,然后滴加1mol/L的鹽酸,測得生成沉淀的質量與消耗鹽酸的體積關系如
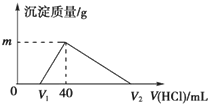
A. 原合金質量為0.92g B. 圖中V2的值為60
C. 圖中m的值為1.56 D. 產生氫氣的體積為896mL(標準狀況下)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com