
【題目】下列關于蔗糖屬于非還原型糖,而其水解產物具有還原性的實驗方案的說法中,正確的是

A. 驗證蔗糖屬于非還原型糖的操作順序:④③
B. 驗證蔗糖屬于非還原型糖的操作順序:③⑤
C. 驗證蔗糖水解產物具有還原性的操作順序:①④⑤
D. 驗證蔗糖水解產物具有還原性的操作順序:①⑤②④⑤
科目:高中化學 來源: 題型:
【題目】Ⅰ![]() 利用下圖裝置驗證同主族元素非金屬性的變化規律。
利用下圖裝置驗證同主族元素非金屬性的變化規律。
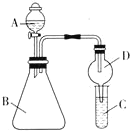
(1)若要證明非金屬性:Cl>I,A中加濃鹽酸,B中加KMnO4(KMnO4與濃鹽酸常溫下反應生成氯氣![]() ,C中加淀粉碘化鉀溶液,觀察到C溶液中的現象是__________,即可證明。可用__________溶液吸收尾氣。
,C中加淀粉碘化鉀溶液,觀察到C溶液中的現象是__________,即可證明。可用__________溶液吸收尾氣。
(2)若要證明非金屬性:C>Si,則在A中加鹽酸,B中加CaCO3,C中加Na2SiO3溶液,觀察到C中溶液的現象是__________,即可證明。但有的同學認為鹽酸具有揮發性,應用__________溶液除去。
Ⅱ![]() 利用甲烷與氯氣發生取代反應的副產品生產鹽酸的設想在工業上已成為現實。某化學興趣小組擬在實驗室中模擬上述過程,所設計的裝置如下圖所示:
利用甲烷與氯氣發生取代反應的副產品生產鹽酸的設想在工業上已成為現實。某化學興趣小組擬在實驗室中模擬上述過程,所設計的裝置如下圖所示:
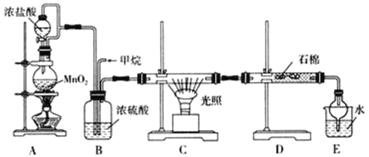
(1)A中制取氯氣反應的化學方程式是_______________。
(2)D裝置中的石棉上吸附著潮濕的KI粉末,其作用是__________。
(3)E裝置的作用是_________(填序號)。
A.收集氣體 B. 吸收氯氣 C.吸收氯化氫
(4)E裝置中除了有鹽酸生成外,還含有有機物,從E中分離出鹽酸的最佳方法是__________。
(5) 將1molCH4與Cl2發生取代,測得4種有機取代物的物質的量相等,則消耗的氯氣的物質的量是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微量元素硼和鎂對植物的葉的生長和人體骨骼的健康有著十分重要的作用,其化合物也應用廣泛。
(1)基態B原子的電子排布圖為________________________,其第一電離能比Be___________(填“大”或“小”)。
(2)三價B易形成配離子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的結構簡式為___________ (標出配位鍵),其中心原子的雜化方式為________,寫出[BH4]-的一種陽離子等電子體_______。
(3)下圖表示多硼酸根的一種無限長的鏈式結構,其化學式可表示為____________(以n表示硼原子的個數)。

(4)硼酸晶體是片層結構,下圖表示的是其中一層的結構。每一層內存在的作用力有_________。

(5)三氯化硼的熔點比氯化鎂的熔點低,原因是_______________________。
(6)鎂單質晶體中原子的堆積模型如下圖,它的堆積模型名稱為_______;緊鄰的四個鎂原子的中心連線構成的正四面體幾何體的體積是2a cm3,鎂單質的密度為ρ g·cm-3,已知阿伏伽德羅常數為NA,則鎂的摩爾質量的計算式是________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著人們對硒的性質深入認識及產品硒的純度提高,硒的應用范圍越來越廣。某科學小組以硫鐵礦生產硫酸過程中產生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,設計流程如下:

回答下列問題:
(1)“脫硫”時,測得脫硫率隨溫度的變化如圖。隨著溫度的升高,脫硫率呈上升趨勢,其原因是______。最佳溫度是________。

(2)“氧化酸浸”中,Se轉化成H2SeO3,該反應的離子方程式為________。
(3)采用硫脲[(NH2)2CS]聯合亞硫酸鈉進行“控電位還原”,將電位高的物質先還原,電位低的物質保留在溶液中,以達到硒與雜質金屬的分離。下表是“氧化酸浸”液中主要粒子的電位。

①控制電位在0.740~1.511V范圍內,在氧化酸浸液中添加硫脲,可選擇性還原ClO2。該過程的還原反應(半反應)式為___________。
②為使硒和雜質金屬分離,用亞硫酸鈉還原時的最低電位應控制在_____V。
(4)粗硒的精制過程:Na2SO3浸出[Se轉化成硒代硫酸鈉(Na2SeSO3)]→Na2S凈化→H2SO4酸化等步驟。
①凈化后的溶液中c(Na2S)達到0.026 mol·L-1,此時溶液中的c(Cu2+)的最大值為________,精硒中基本不含銅。[Ksp(CuS)=1.3×10-36]
②硒代硫酸鈉酸化生成硒的化學方程式為____________。
(5)對精硒成分進行熒光分析發現,精硒中鐵含量為32 μg·g-1,則精硒中鐵的質量分數為___________,與粗硒中鐵含量為0.89%相比,鐵含量明顯降低。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物 W 在醫藥和新材料等領域有廣泛應用。W 的一種合成路線如圖:
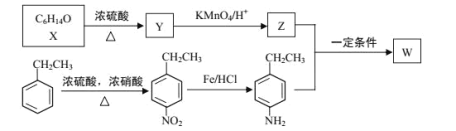
已知部分信息如下:
① | 1molY完全反應生成2molZ,且在加熱條件下Z不能和新制氫氧化銅懸濁液反應 |
② |
|
③ | RCH2NH2+ |
請回答下列問題:
(1)Y 的化學名稱是___;Z 中官能團的名稱是___;
(2)![]() 中_____________(填“有”或“無”)手性碳原子;圖示中 X 轉化為 Y 的反應類型是___。
中_____________(填“有”或“無”)手性碳原子;圖示中 X 轉化為 Y 的反應類型是___。
(3)生成 W 的化學方程式為___。
(4)G 是對硝基乙苯的同分異構體,G 能和碳酸鈉反應產生氣體且分子中含有—NH2(氨基),G的同分異構體有___種(不考慮立體結構),其中在核磁共振氫譜上峰的面積比為 1∶2∶2∶2∶2 的結構簡式為_________________。
(5)設計以苯乙烯和丙酮為原料制備藥物中間體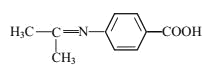 的合成路線__________(無機試劑自選)。
的合成路線__________(無機試劑自選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在固定容積為2L的密閉容器中進行如下反應:A(g)+2B(g)![]() 3C(g)+nD(g),開始時A的物質的量為2mol,B的物質的量為3mol;5min末測得C的物質的量為1.5mol,用D表示的化學反應速率
3C(g)+nD(g),開始時A的物質的量為2mol,B的物質的量為3mol;5min末測得C的物質的量為1.5mol,用D表示的化學反應速率![]() (D))為0.1mol·L-1·min-1。計算:
(D))為0.1mol·L-1·min-1。計算:
(1)前5min內用A表示的化學反應速率v(A)為__。
(2)化學方程式中n的值為__。
(3)此反應在四種不同情況下的反應速率分別為
①![]() (A)=1mol·L-1·s-1②
(A)=1mol·L-1·s-1②![]() (B)=4mol·L-1·min-1③
(B)=4mol·L-1·min-1③![]() (C)=3mol·L-1·min-1④
(C)=3mol·L-1·min-1④![]() (D)=7mol·L-1·min-1
(D)=7mol·L-1·min-1
其中反應速率最快的是__(填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇(CH3CH2OH)既是生活中常見的有機物,又是重要的化工原料。
(1)工業上可用乙烯制備乙醇的化學方程式為:CH2 = CH2+H2O![]() CH3CH2OH,該反應屬于____反應(填“加成”或“取代”)。
CH3CH2OH,該反應屬于____反應(填“加成”或“取代”)。
(2)官能團決定有機物的性質。乙醇中含有的官能團名稱是______。
(3)為探究乙醇的性質,某學生向試管中加入3mL乙醇,將下端繞成螺旋狀的銅絲在酒精燈火焰上灼燒至紅熱后,迅速插入乙醇中,可觀察到銅絲表面由黑色變成紅色,說明乙醇具有______性。
(4)萃取是物質分離的一種方法。某學生擬用乙醇萃取溴水中的Br2,判斷該方法是否可行:_____(填“是”或“否”),判斷的理由是________。
(5)某液態有機物不溶于水,將它和水分離開來的方法是_______ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一無色透明溶液,欲確定是否含有下列離子:
Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、SO32-、HCO
、Cl-、SO32-、HCO![]() ,取該溶液進行以下實驗:
,取該溶液進行以下實驗:
①取少量待測液,加入幾滴石蕊試液,溶液呈紅色。
②取少量待測液,濃縮后加入銅片和濃硫酸,加熱,有無色氣體產生,此無色氣體遇空氣變成紅棕色。
③取少量待測液,加入BaCl2溶液,有白色沉淀產生。
④取實驗③中上層清液滴加AgNO3溶液,有白色沉淀產生,此沉淀不溶于稀硝酸。
⑤另取少量原溶液滴加NaOH溶液,有白色沉淀產生,當NaOH過量時,沉淀部分溶解。
(1)根據以上實驗,溶液中肯定存在的離子是_________________;肯定不存在的離子是______________;尚不能確定的離子是_______________。
(2)寫出②中有關反應的離子方程式:________________________________________。
(3)寫出⑤中沉淀溶解的離子方程式:________________________________________。
(4)實驗室檢驗Na+一般用焰色反應即可確定,此實驗做之前要用______清洗鉑絲。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com