
【題目】某反應中反應物與生成物有:濃H2SO4、K2S、K2SO4、SO2、H2O和一種未知物質(zhì)X。
(1)已知K2S在反應中失去電子,則該反應的氧化劑是_____,_____被氧化。
(2)已知0.5molK2S在反應中失去1mol電子生成X,則X的化學式為_____。
(3)按還原劑和氧化劑順序?qū)⒎磻锾钊胂铝锌崭裰校淦剑顺鲭娮愚D(zhuǎn)移的方向和數(shù)目:
![]() ___________________
___________________
(4)若反應中濃H2SO4過量,則產(chǎn)物中無X生成,請完成此反應的化學方程式:_____。在上述過程中,若有0.4mol濃硫酸被還原,反應中轉(zhuǎn)移電子的物質(zhì)的量為_____mol。
【答案】濃硫酸 K2S S 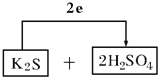 4H2SO4(濃)+K2S=K2SO4+4SO2↑+4H2O 0.8
4H2SO4(濃)+K2S=K2SO4+4SO2↑+4H2O 0.8
【解析】
(1)已知K2S在反應中失去電子硫元素化合價升高,則該反應的氧化劑為濃硫酸,硫元素化合價降低;
(2)已知0.5molK2S在反應中失去1mol電子生成X,濃硫酸被還原為二氧化硫,結(jié)合電子守恒計算分析硫元素化合價;
(3)計算得到K2S被氧化為S,濃硫酸被還原為SO2,電子轉(zhuǎn)移依據(jù)元素化合價變化計算得到2e﹣;
(4)若反應中濃H2SO4過量產(chǎn)物中無S生成,說明硫化鉀被氧化為二氧化硫,利用化學方程式定量關系計算若有0.4mol濃硫酸被還原,反應中轉(zhuǎn)移電子的物質(zhì)的量。
(1)反應物與生成物有:濃H2SO4、K2S、K2SO4、SO2、H2O和一種未知物質(zhì)X,已知K2S在反應中失去電子硫元素化合價升高,則該反應的氧化劑為濃硫酸,硫元素化合價降低,K2S中硫元素化合價升高被氧化生成S;
故答案為:濃硫酸;K2S;
(2)已知0.5molK2S在反應中失去1mol電子生成X硫元素化合價為x,濃硫酸被還原為二氧化硫,結(jié)合電子守恒計算分析硫元素化合價,[x﹣(﹣2)]×0.5mol=1,x=0,則生成的X為S,
故答案為:S;
(3)計算得到K2S被氧化為S,濃硫酸被還原為SO2,電子轉(zhuǎn)移依據(jù)元素化合價變化和電子守恒計算得到2e﹣,則氧化劑為濃硫酸和還原劑為K2S,配平后系數(shù)填入空格中,標出電子轉(zhuǎn)移的方向和數(shù)目為: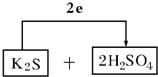 ;
;
故答案為: ;
;
(4)若反應中濃H2SO4過量產(chǎn)物中無S生成,同種元素不同價態(tài)間發(fā)生氧化還原反應最大程度發(fā)生歸中反應,說明硫化鉀被氧化為二氧化硫,反應的化學方程式為:4H2SO4(濃)+K2S=K2SO4+4SO2↑+4H2O,在上述過程中,3mol硫酸被還原,電子轉(zhuǎn)移6mol電子,若有0.4mol濃硫酸被還原,反應中轉(zhuǎn)移電子的物質(zhì)的量為0.8mol;
故答案為:4H2SO4(濃)+K2S=K2SO4+4SO2↑+4H2O;0.8。


科目:高中化學 來源: 題型:
【題目】翡翠是玉石中的一種,其主要成分為硅酸鋁鈉NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列問題:
(1)Cr3+電子排布式為______________________,基態(tài)Si原子中,電子占據(jù)的最高能層符號為______________________。
(2)翡翠中主要成分為硅酸鋁鈉,四種元素的第一電離能由大到小的順序___________。
(3)錳的一種化合物的化學式為Mn(BH4)2(THF)3,THT的結(jié)構(gòu)簡式如圖所示:

①THF中C原子的雜化軌道類型為___________,②BH4-的空間構(gòu)型為___________
③NaBH4所含化學鍵類型有_____________
A、離子鍵 B、共價鍵 C、氫鍵 D、配位鍵
(4)MnO的熔點(1660℃)比MnS的熔點(1610℃)高,原因______________________。
(5)Ni可以形成多種氧化物,其中一種NixO晶體的晶胞結(jié)構(gòu)為NaCl型,由于晶體缺陷,x為0.88,且晶體中Ni的存在形式為Ni2+、Ni3+,則晶體中N i2+和Ni3+最簡整數(shù)比為___________,該晶體的晶胞參數(shù)為428pm,則晶體密度為___________g·cm-3(NA表示阿伏加德羅常數(shù)的值,列出表達式即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質(zhì)在水中可能存在電離平衡、鹽的水解平衡和沉淀的溶解平衡,它們都可看作化學平衡。請根據(jù)所學知識的回答:
(1)A為0.1 mol·L-1的(NH4)2SO4溶液,在該溶液中各種離子的濃度由大到小順序為____________________________。
(2)B為0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各種平衡體系為(用離子方程式表示):________________________________________________________________________________________________________________________________________________;實驗測得NaHCO3溶液的pH > 7,請分析NaHCO3溶液顯堿性的原因:_________________________。
(3)C為FeCl3溶液,實驗室中配制FeCl3溶液時通常需要向其中加入鹽酸目的是________________________________________。若把B和C溶液混合,將產(chǎn)生紅褐色沉淀和無色氣體,該反應的離子方程為___________________________________。
(4)D為含有足量AgCl固體的飽和溶液,氯化銀在水中存在沉淀溶解平衡:AgCl(S) ![]() Ag+(aq)+ Cl-(aq),在25℃時,氯化銀的Ksp = 1.8×10-10mol2·L-2。現(xiàn)將足量氯化銀分別放入:①100mL蒸餾水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化鋁溶液中;④100mL 0.1 mol·L-1鹽酸溶液中。充分攪抖后,相同溫度下銀離子濃度由大到小的順序是____________(填寫序號)
Ag+(aq)+ Cl-(aq),在25℃時,氯化銀的Ksp = 1.8×10-10mol2·L-2。現(xiàn)將足量氯化銀分別放入:①100mL蒸餾水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化鋁溶液中;④100mL 0.1 mol·L-1鹽酸溶液中。充分攪抖后,相同溫度下銀離子濃度由大到小的順序是____________(填寫序號)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦酸鋰電池應用廣泛, 電池放電后負極材料主要含有Li4Ti5O12、 鋁箔及少量Fe, 可通過下列工藝流程回收鈦、 鋰。回答下列問題:

(1) Li4Ti5O12中, Ti元素的化合價為___, 濾液1中含金屬的陰離子是___(填離子符號)。
(2) 酸浸時 Li4Ti5O12發(fā)生的反應是: Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O, 該反應是否屬于氧化還原反應?___(填 “是” 或 “否”); 濾渣1是___。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液發(fā)生反應的離子方程式為___。
(4) 向TiOSO4溶液中通入NH3發(fā)生反應的離子方程式為___。
(5) 沉淀TiO(OH)2用蒸餾水洗滌的目的是___。
(6) 萃取時, 溫度對萃取率的影響如圖所示。由圖分析知實驗時選擇在常溫下進行即可, 理由是__。

(7)“萃取” 和 “反萃取” 可簡單表示為:[TiO(H2O2)]2++2(HA)2![]() [TiO(H2O2)](HA2)2+2H+,則反萃取過程中加入的試劑X是___。
[TiO(H2O2)](HA2)2+2H+,則反萃取過程中加入的試劑X是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今有A,B兩種元素,A的+1價陽離子與B的-2價陰離子的電子層結(jié)構(gòu)與氖相同。
(1)用電子式表示A與B兩種元素構(gòu)成的兩種化合物分別為__________________和__________________,前者只有__________鍵;后者既有________鍵,又有________鍵。
(2)A的氫化物的電子式為_______,其中含有________鍵,它與水反應的化學方程式為____________。
(3)元素B的氣態(tài)氫化物的電子式為___________________________________________,該分子中的鍵屬于________(填“極性”或“非極性”)鍵,該氫化物與H+形成的鍵屬于________。
(4)元素A的最高價氧化物的水化物的電子式為____________,其中既有________鍵,又有________鍵。
(5)B元素的單質(zhì)有__________和__________,二者互稱為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸是重要的化工產(chǎn)品,在基礎化學試驗中,有著重要的作用。
Ⅰ.物質(zhì)的量濃度為18.4mol/L、質(zhì)量分數(shù)為0.98的濃硫酸吸收水蒸氣時,當其質(zhì)量分數(shù)下降到0.87(密度1.8g/cm3)以下時,則失去干燥能力。質(zhì)量分數(shù)為0.87的硫酸的物質(zhì)的量濃度為_____(保留兩位小數(shù))。50mL8.4mol/L的濃硫酸作為干燥劑時,最多可吸水_____g.(保留兩位小數(shù))
Ⅱ.若用上述質(zhì)量分數(shù)為0.98的硫酸,配制200mL物質(zhì)的量濃度為0.46mol/L的硫酸,
(1)所需的濃硫酸的體積為_____mL,(保留一位小數(shù))
(2)現(xiàn)有下列幾種規(guī)格的儀器,本實驗應選用_____(填序號);
①10mL量筒 ②50mL 量筒 ③100mL 量筒 ④100mL 容量瓶 ⑤200mL 容量瓶
(3)完成該實驗除了燒杯外,還要的儀器有_____、_____;
(4)下列操作使所配溶液的物質(zhì)的量濃度偏高的_____(填序號),對配制結(jié)果沒有影響的是_____(填序號)。
a.用量筒量取濃H2SO4,慢慢地沿著玻璃棒注入盛有50mL蒸餾水的小燒杯,攪拌后,立即轉(zhuǎn)移到容量瓶中。
b.往容量瓶轉(zhuǎn)移溶液時,有少量液體濺出。
c.未洗滌稀釋濃H2SO4的小燒杯。
d.定容時仰視。
e.容量瓶未干燥即用來配制溶液。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個密閉容器中,有一個左右可滑動隔板,兩邊分別進行可逆反應,各物質(zhì)的量如下:M、N、P為2.5mol、3.0mol、1.0mol。A、C、D各為0.50mol,B的物質(zhì)的量為x,當x的物質(zhì)的量在一定范圍內(nèi)變化,均可以通過調(diào)節(jié)反應器的溫度,使兩側(cè)反應均達到平衡,且隔板在反應器的正中位置。達到平衡后,測得M的轉(zhuǎn)化率為75%,填寫空白:
![]()
(1)達到平衡后,反應器左室氣體總的物質(zhì)的量為____________________mol。
(2)若要使右室反應開始時V正>V逆,x的取值范圍_____________________。
(3)若要使右室反應開始時V正<V逆,x的取值范圍_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業(yè)上生產(chǎn)氮化硅陶瓷反應為3SiCl4+2N2+6H2![]() Si3N4+12HCl,有關該反應說法正確的是
Si3N4+12HCl,有關該反應說法正確的是
A. SiCl4是氧化劑 B. N2發(fā)生還原反應
C. H2被還原 D. N2失電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮氧化合物的治理是環(huán)保的一項重要工作,合理應用和處理氮的化合物,在生產(chǎn)生活中有著重要的意義。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小組嘗試利用固體表面催化工藝進行NO的分解。若用●● 、●○ 、○○和![]() 分別表示N2 、NO、O2和固體催化劑,在固體催化劑表面分解NO的過程如下圖所示。從吸附到解吸的過程中,能量狀態(tài)最低的是___________(填字母序號)。
分別表示N2 、NO、O2和固體催化劑,在固體催化劑表面分解NO的過程如下圖所示。從吸附到解吸的過程中,能量狀態(tài)最低的是___________(填字母序號)。

(2)為減少汽車尾氣中NOx的排放,常采用CxHy(烴)催化還原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
則△H3=___________。
(3)亞硝酰氯(ClNO)是有機合成中常用試劑,已知:2NO(g)+Cl2(g)![]() 2 ClNO(g) △H<0
2 ClNO(g) △H<0
①一定溫度下,將2 molNO與2 molCl2置于2L密閉容器中發(fā)生反應,若該反應4min后達平衡,此時壓強是初始的0.8倍,則平均反應速率v(Cl2)=___________mol·L-1·min-1。下列可判斷反應達平衡狀態(tài)的是___________(項序號字母)。
A 混合氣體的平均相對分子質(zhì)量不變
B 混合氣體密度保持不變
C NO和Cl2的物質(zhì)的量之比保持不變
D 每消耗1 moI NO同時生成1molClNO
②為了加快化學反應速率,同時提高NO的轉(zhuǎn)化率,其他條件不變時,可采取的措施有___________(填選項序號字母)。
A 升高溫度 B 縮小容器體積
C 再充入Cl2氣體 D 使用合適的催化劑
③一定條件下在恒溫恒容的密閉容器中,按一定比例充入NO(g)和Cl2(g),平衡時ClNO的體積分數(shù)隨n(NO)/n(Cl2)的變化圖像如圖(b)所示,當n(NO)/n(Cl2)=2.5時,達到平衡狀態(tài),ClNO的體積分數(shù)可能是圖中D、E、F三點中的___________點。

(4)已知2NO(g)+O2(g)![]() 2NO2(g)的反應歷程分兩步:
2NO2(g)的反應歷程分兩步:
①2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比較反應①的活化能E1與反應②的活化能E2的大小:E1___________E2(填“>”、"<”或“=”):2NO(g)+O2(g)![]() 2NO2(g)的平衡常數(shù)K與上述反應速率常數(shù)k1正、k1逆、k2正、k2逆的關系式為___________。
2NO2(g)的平衡常數(shù)K與上述反應速率常數(shù)k1正、k1逆、k2正、k2逆的關系式為___________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com