
【題目】某溶液能與Al粉反應放出H2,該溶液中可能大量共存的離子組是
A.NH![]() 、Ba2+、HCO
、Ba2+、HCO![]() 、Cl-B.K+、Al3+、SO
、Cl-B.K+、Al3+、SO![]() 、ClO-
、ClO-
C.Na+、Fe3+、Cl-、SO![]() D.NH
D.NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】有機物X、Y、M相互轉化關系如下。下列有關說法不正確的是

A. 可用碳酸氫鈉區別X與Y
B. Y中所有原子在同一平面上
C. X、Y、M均能發生加成、氧化和取代反應
D. X環上的二氯代物共有11種(不考慮順反異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】橋環烷烴雙環[2.2.1]庚烷的結構簡式如圖所示,下列關于該化合物的說法錯誤的是
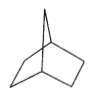
A. 與環庚烯互為同分異構體
B. 二氯代物結構有9種
C. 所有碳原子不能處于同一平面
D. 1mol雙環[2.2.1]庚烷完全燃燒至少需要10 molO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在銅、鋅、稀硫酸構成的原電池中(如圖所示)。
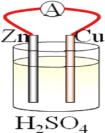
(1)負極是__(填“銅”或“鋅”),__電子(填“失去”或“得到”),發生__反應(填“氧化”或“還原”),電極反應方程式___;正極是__(填“銅”或“鋅”)__電子(填“失去”或“得到”),發生__反應(填“氧化”或“還原”),電極反應方程式__。
(2)電流由___流向___(填“銅”或“鋅),銅片上觀察到的現象是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車劇烈碰撞時,安全氣囊中發生反應:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化產物比還原產物多1.75mol,則下列判斷不正確的是
A. 生成44.8L N2(標準狀況)
B. 有0.25 mol KNO3被還原
C. 轉移電子的物質的量為1.75mol
D. 被氧化的N原子的物質的量為3.75mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯磺酸是無色液體,密度1.79g·cm-3,沸點約152℃。氯磺酸有強腐蝕性,遇濕空氣產生強烈的白霧,故屬于危險品。制取氯磺酸的典型反應是在常溫下進行的,反應為 HCl(g)+SO3 = HSO3Cl。實驗室里制取氯磺酸可用下列儀器裝置(圖中夾持、固定儀器等已略去),實驗所用的試劑、藥品有:①密度1.19g·cm-3濃鹽酸 ②密度1.84g·cm-3、質量分數為98.3%的濃硫酸 ③發煙硫酸(H2SO4··SO3) ④無水氯化鈣 ⑤水。制備時要在常溫下使干燥的氯化氫氣體和三氧化硫反應,至不再吸收HCl時表示氯磺酸已大量制得,再在干燥HCl氣氛中分離出氯磺酸。
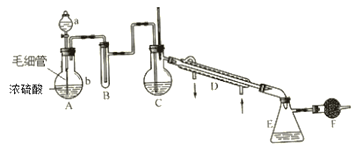
(1)儀器中應盛入的試劑與藥品(填數字序號):A中的a____ B____ C_____ F_____ 。
(2)A的分液漏斗下邊接有的毛細管是重要部件,在發生氣體前要把它灌滿a中液體,在發生氣體時要不斷地均勻放出液體。這是因為______________________________________。
(3)實驗過程中需要加熱的裝置是___________________ (填裝置字母)。
(4)若不加F裝置,可能發生的現象是________________________________________, 有關反應的化學方程式______________________________________________________。
(5)在F之后還應加的裝置是_______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將足量的CO2不斷通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,則生成沉淀的物質的量與通入CO2的體積的關系可表示為( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe+H2SO4=FeSO4+H2↑的能量變化趨勢如下圖所示:
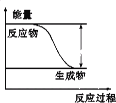
(1)該反應為_______反應(填“吸熱”或“放熱”)。
(2)若要使該反應的反應速率加快,下列措施可行的是_______(填字母)
A.改鐵片為鐵粉 B.改稀硫酸為98%的濃硫酸 C.升高溫度 D.減小壓強
(3)若將上述反應設計成原電池,銅為原電池某一極材料,則銅為_________極(填“正”或“負”)。銅片上產生的現象為_________,外電路中電子由________電極(填“Fe”或“Cu”,下同),向________電極移動。
(4)若依據氧化還原反應:Cu2++Fe=Cu+Fe2+設計的原電池如下圖所示,請回答下列問題:
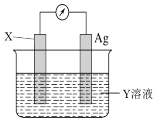
電極X的材料是________,電解質溶液Y是_________,X電極上發生的電極反應式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
我國科學家最近成功合成了世界上首個五氮陰離子鹽(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列問題:
(1)氮原子價層電子對的軌道表達式(電子排布圖)為_____________。
(2)元素的基態氣態原子得到一個電子形成氣態負一價離子時所放出的能量稱作第一電子親和能(E1)。第二周期部分元素的E1變化趨勢如圖(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈現異常的原因是__________。
(3)經X射線衍射測得化合物R的晶體結構,其局部結構如圖(b)所示。
①從結構角度分析,R中兩種陽離子的相同之處為_________,不同之處為__________。(填標號)
A.中心原子的雜化軌道類型 B.中心原子的價層電子對數
C.立體結構 D.共價鍵類型
②R中陰離子N5-中的σ鍵總數為________個。分子中的大π鍵可用符號![]() 表示,其中m代表參與形成的大π鍵原子數,n代表參與形成的大π鍵電子數(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成的大π鍵原子數,n代表參與形成的大π鍵電子數(如苯分子中的大π鍵可表示為![]() ),則N5-中的大π鍵應表示為____________。
),則N5-中的大π鍵應表示為____________。
③圖(b)中虛線代表氫鍵,其表示式為(NH4+)N-H┄Cl、____________、____________。

(4)R的晶體密度為d g·cm-3,其立方晶胞參數為a nm,晶胞中含有y個[(N5)6(H3O)3(NH4)4Cl]單元,該單元的相對質量為M,則y的計算表達式為______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com