
【題目】欲用含有少量氯化鈣的氯化鈉固體,配制100 mL a mol·L-1的氯化鈉溶液,設計了下面的操作方案。根據方案操作步驟回答下列問題:

(1)稱量粗鹽樣品m g,在托盤天平左盤上放________,右盤上放_______。
(2)蒸發操作時應將液體放在________中加熱,等加熱至________時即停止加熱。
(3)在樣品的溶液中加入過量的Na2CO3溶液,作用是_________________________________,
反應的化學方程式是______________________________________________________。
(4)在濾液中加入鹽酸的作用是____________________________________,
反應的化學方程式是____________________________________________。
(5)配制100 mL a mol·L-1的NaCl溶液時,應從W g固體中稱取NaCl的質量為________。
【答案】粗鹽(放在稱量紙上)砝碼(放在稱量紙上)蒸發皿出現大量晶體使鈣離子完全形成沉淀而除去CaCl2+Na2CO3===CaCO3↓+2NaCl除去過量的Na2CO3Na2CO3+2HCl===2NaCl+H2O+CO2↑5.85a g
【解析】
(1)稱量時左物右碼;(2)蒸發在蒸發皿中進行,當加熱到剩有少量液體時停止加熱用余熱蒸干;(3)Na2CO3是除雜試劑,加入過量的目的是把雜質除得更干凈;(4)鹽酸也是除雜試劑,用于除去所加的過量碳酸鈉;(5)用W g NaCl配制100 mL a mol·L-1的NaCl溶液應稱取NaCl的質量為100 mL×10-3 L·mL-1×a mol·L-1×58.5 g·mol-1=5.85a g.
(1)稱量時左物右碼,因此粗鹽放在托盤天平的左盤,砝碼放在托盤天平的右盤;(2)蒸發操作時應將液體放在蒸發皿中加熱,等加熱至出現大量晶體時即停止加熱;(3)在樣品的溶液中加入過量的Na2CO3溶液,作用是除掉鈣離子,反應的化學方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl;(4)在濾液中加入鹽酸的作用是除掉過量的除雜試劑Na2CO3,反應的化學方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑;(5)配制100mL a mol·L-1的NaCl溶液時,n(NaCl)=0.1×a mol,m(NaCl)=0.1×a mol×58.5g·mol-1=5.85a g。.


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】下列有關化學用語的表示正確的是( )
A. 甲烷的球棍模型:![]() B. 氯離子的結構示意圖:
B. 氯離子的結構示意圖:![]()
C. 氮氣的結構式:∶N≡N∶ D. 氯化氫的電子式:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是

A. X→Y反應類型為酯化反應
B. X、Y、Z均能使溴的四氯化碳溶液褪色
C. Y和Z互為同分異構體
D. 等物質的量的X、Z分別與足量Na反應,消耗Na的物質的量之比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于同分異構體的敘述正確的是
A. 相對分子質量相同而結構不同的化合物互稱為同分異構體
B. 化學式相同而結構不同的化合物互稱為同分異構體
C. 同分異構體之間由于分子組成相同,所以它們的性質相同
D. 只有少數的有機物之間存在同分異構現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.CH3COOH和CH3COOCH3互為同系物B.氧氣和臭氧互為同位素
C.C5H12有四種同分異構體D.金剛石和石墨互為同素異形體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學學習小組在幫助老師整理實驗室的化學試劑時,發現一盛無色鹽溶液的試劑瓶,標簽破損如右圖,該小組根據已掌握的知識,對藥品作出猜想,并設計實驗驗證。

(1)該實驗藥品為中學化學常用試劑,推測它的陽離子化合價為______________________。
(2)同學們做出以下三種推測。
猜想1:Na2SO4
實驗設計: 進行……,.證明是Na2SO4溶液;
猜想2: K2SO4
實驗設計:____________________________,證明是K2SO4溶液;
猜想3; (NH4)2SO4
實驗設計:____________________________,證明是(NH4)2SO4溶液。
(3)通過實驗發現“猜想3”成立,已知(NH4)2SO4受熱易分解,該小組擬用下圖所示裝置探究其分解產物。(夾持和加熱裝置略)

實驗I:裝置B 盛0.5000mol/L鹽酸50.00mL,通入N2排盡空氣后,將裝置A 加熱至260℃一段時間,停止加熱,停止通入N2,品紅溶液不褪色,取下裝置B,用0.1000mol/LNaOH溶液滴定剩余鹽酸,消耗NaOH 溶液50.00mL。經檢驗滴定后的溶液中無SO42-。

①請從右圖選擇盛放0.1000mol/LNaOH 溶液的滴定管____________(填“甲”或“乙”)。
②裝置B 內溶液吸收氣體的物質的量是_____________________mol。
實驗Ⅱ:通入N2排盡空氣后,將裝置A 加熱到400℃,至固體無殘留,停止加熱,停止通入N2,觀察到裝置A、D之間的導氣管內有少量白色固體。經檢驗,該白色固體和裝置D內溶液中有SO32-,無SO42-。
①裝置E 的作用是____________________________。
②A、D之間的導氣管內的少量白色固體是____________________________。
③有同學提出在AD之間需要增加一個防倒吸的安全瓶,老師說不需要,原因是____________________________。
④進一步研究發現,氣體產物中無氮氧化物,則(NH4)2SO4在400℃分解的化學方程式是_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,向20 mL 0.1 mol/L的醋酸溶液中不斷滴入0.1 mol/L的NaOH溶液,溶液的pH變化曲線如圖所示。在滴定過程中,關于溶液中離子濃度大小關系的描述正確的是
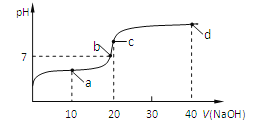
A.a點時:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-)
B.b點時:c(Na+)=c(CH3COO-)
C.c點時:c(H+)=c(CH3COOH)+c(OH-)
D.d點時:c(Na+) c(OH-) c(CH3COO-) c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com