
【題目】煙氣的脫硝(除![]() )技術和脫硫(除
)技術和脫硫(除![]() )技術都是目前環境科學研究的熱點。
)技術都是目前環境科學研究的熱點。
(1)工業上可以采用“質子膜電解槽”對煙氣進行脫硫脫硝,其工藝如圖甲所示:
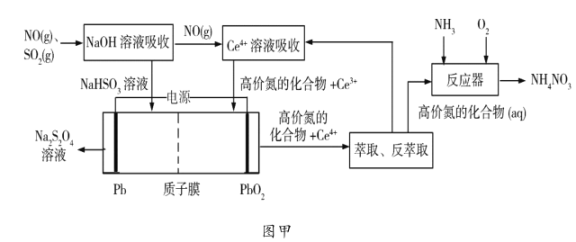
①![]() 溶液吸收
溶液吸收![]() 主要反應的化學方程式為___________;
主要反應的化學方程式為___________;
②電解的主要目的是______________,陰極的電極反應式為______________;
③“高價氮的化合物”中NO2在反應器中發生化合反應的化學方程式為______;
(2)利用活性焦炭的吸附作用,可以對煙氣進行脫硫和脫硝。被吸附的![]() 與活性焦炭反應生成
與活性焦炭反應生成![]() 和
和![]() ,當生成
,當生成![]() 時,轉移電子的物質的量為__________
時,轉移電子的物質的量為__________![]() ;
;
(3)一定條件下,將一定濃度NOx(NO2和NO的混合氣體)通入![]() 的
的![]() 乳濁液中,發生的反應如下:
乳濁液中,發生的反應如下:![]() ,
,![]() ,改變
,改變![]() ,
,![]() 的去除率變化情況如圖乙所示。
的去除率變化情況如圖乙所示。
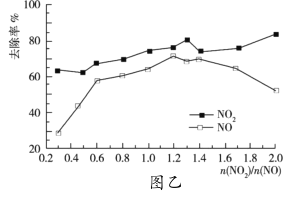
①當![]() 大于1.4時,
大于1.4時,![]() 去除率升高,但
去除率升高,但![]() 的去除率卻降低。其可能的原因是__;
的去除率卻降低。其可能的原因是__;
②![]() 和
和![]() 發生的主要反應為
發生的主要反應為![]() 。保持
。保持![]() 的初始濃度不變,改變
的初始濃度不變,改變![]() ,將反應后的混合氣體通入
,將反應后的混合氣體通入![]() 乳濁液中吸收。為節省
乳濁液中吸收。為節省![]() 的用量,又能保持
的用量,又能保持![]() 去除效果,則
去除效果,則![]() 合適的值約為___________;
合適的值約為___________;
(4)已知:![]() ,
,![]() ,則
,則![]() ______________________。
______________________。
【答案】![]() 再生
再生![]()
![]()
![]() 8
8 ![]() 和
和![]() 反應生成
反應生成![]() 和
和![]() ,導致
,導致![]() 的去除率降低 0.6
的去除率降低 0.6 ![]()
【解析】
(1)由流程圖可知,將煙氣通入氫氧化鈉溶液中,二氧化硫與氫氧化鈉溶液反應生成亞硫酸氫鈉溶液,未反應的一氧化氮進入含有Ce4+的吸收液中,一氧化氮與Ce4+反應生成Ce3+和高價氮的化合物;在電解池中,酸性條件下,亞硫酸氫鈉在陰極上得到電子發生還原反應生成Na2S2O4,Ce3+在陽極失去電子發生氧化反應生成Ce4+;Ce4+和高價氮的化合物經過萃取和反萃取分離得到Ce4+和高價氮的化合物,Ce4+進入Ce4+的吸收液中循環使用,高價氮的化合物進入氣液反應器中與氨氣和氧氣反應生成硝酸銨;
(2)由題意可知,被吸附的二氧化氮與活性焦炭反應生成氮氣和二氧化碳,反應的化學方程式為2NO2+2C=N2+2CO2,結合方程式中的定量關系計算電子轉移總數;
(3)①當![]() 大于1.4時,NO2去除效率升高,但NO去除效率卻降低是因為二氧化氮反應生成一氧化氮;
大于1.4時,NO2去除效率升高,但NO去除效率卻降低是因為二氧化氮反應生成一氧化氮;
②O3和NO反應的化學方程式為NO+O3=NO2+O2,NO和NO2與氫氧化鈣溶液反應的化學方程式為NO+ NO2+2OH-=2NO2-+ H2O,由圖可知二氧化氮和一氧化氮的物質的量比為1.4時NOx去除效果最好;
(4)由蓋斯定律計算可得。
(1)①由分析可知氫氧化鈉溶液與二氧化硫反應生成亞硫酸氫鈉,反應的化學方程式為SO2+NaOH═2NaHSO3,故答案為:SO2+NaOH═2NaHSO3;
②由分析可知,電解可以將亞硫酸氫鈉轉化為Na2S2O4,將Ce3+轉化為Ce4+,達到Ce4+再生循環的目的;酸性條件下,亞硫酸氫鈉在陰極上得到電子發生還原反應生成Na2S2O4,電極反應式為![]() ,故答案為:Ce4+再生;
,故答案為:Ce4+再生;![]() ;
;
③“高價氮的化合物”中二氧化氮在氣液反應器中與氨氣和氧氣反應生成硝酸銨反應的化學方程式為![]() ,故答案為:
,故答案為:![]() ;
;
(2)由題意可知,被吸附的二氧化氮與活性焦炭反應生成氮氣和二氧化碳,反應的化學方程式為2NO2+2C=N2+2CO2,由方程式可知,生成1mol氮氣,反應轉移8mol電子,故答案為:8;
(3)①由題意可知,二氧化氮、二氧化氮和一氧化氮混合氣體能與氫氧化鈉溶液反應,一氧化氮不能與氫氧化鈉溶液反應,則當![]() 大于1.4時,NO2和OH反應生成NO
大于1.4時,NO2和OH反應生成NO
②O3和NO反應的化學方程式為NO+O3=NO2+O2,NO和NO2與氫氧化鈣溶液反應的化學方程式為NO+ NO2+2OH-=2NO2-+ H2O,由圖可知二氧化氮和一氧化氮的物質的量比為1.4時NOx去除效果最好,設一氧化氮的物質的量為x,![]() 為a,則臭氧的物質的量為ax,由方程式和可知二氧化氮和一氧化氮的物質的量比為1.2可得ax=1.4(x-ax), 解得x≈0.6,故答案為:0.6;
為a,則臭氧的物質的量為ax,由方程式和可知二氧化氮和一氧化氮的物質的量比為1.2可得ax=1.4(x-ax), 解得x≈0.6,故答案為:0.6;
(4)將已知反應依次編號為①②,由蓋斯定律可知①-②×2可得![]() ,則△H=-905.5kJ/mol-(+180 kJ/mol)×2=-1265.5 kJ/mol,故答案為:1265.5。
,則△H=-905.5kJ/mol-(+180 kJ/mol)×2=-1265.5 kJ/mol,故答案為:1265.5。


科目:高中化學 來源: 題型:
【題目】有機物M的結構結構簡式如圖所示。關于M,下列說法正確的是( )
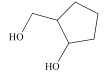
A.分子中所有碳原子可能共平面
B.M的同分異構體中,能與飽和NaHCO3溶液反應有9種
C.可使酸性高錳酸鉀溶液褪色
D.1molM與足量的鈉反應可以生成22.4LH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下,N2(氣)和H2(氣)生成2mol NH3(氣)放出92.4 kJ熱量。現有甲、乙兩個容積相同的密閉容器,在常溫下:①向密閉容器甲中通入1 molN2和3 mol H2,達到平衡時放出熱量Q1kJ。②向密閉容器乙中通入0.5 mol N2和1.5 mol H2,達到平衡時放出熱量Q2kJ。則下列關系式正確的是
A.Q1=2Q2=92.4B.Ql>2Q2C.Q1<2Q2D.Q1=2Q2≠92.4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】amol FeS與bmol FeO投入到VL、c mol/L的硝酸溶液中充分反應產生NO氣體,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,則反應中未被還原的硝酸可能為
( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④![]() mol
mol
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源短缺是人類社會面臨的重大問題,甲醇是一種可再生能源,具有廣泛的開發和應用前景。
(1)已知:CO、H2、CH3OH(g)的燃燒熱分別為283kJ/mol、285.8kJ/mol、768kJ/mol。工業上一般利用合成氣發生下列反應合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成該熱化學方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某溫度下,將2mol CO和6mol H2充入2L的密閉容器中,達到平衡,測得c(H2)= 2.2molL﹣1,則CO的轉化率為______。
(2)T1℃時,此反應的平衡常數為K(T1)= 50。此溫度下,在一個2L的密閉容器中加入一定量CO和H2,反應到某時刻測得各組分的濃度如下:
物質 | H2 | CO | CH3OH(g) |
濃度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比較此時正、逆反應速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他條件不變,在T2℃反應l0min后又達到平衡,測得n(H2)= 0.3mol,試比較:溫度T1___T2(填“>”、“=”或“<”,下同)T2℃時該反應的平衡常數K(T2)______50。
③若其他條件不變時,只改變反應的某一個條件,下列說法正確的是______。
a.若達到新平衡時c(CO)= 0.3mo1/L,平衡一定逆向移動
b.若將容器體積縮小到原來的一半,達到新平衡時,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同時加入0.4mol CO和0.8mol CH3OH(g),平衡不移動
d.若向容器中加入0.8mol CH3OH(g),達到新平衡時,CO的體積分數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeCl3溶液在工業上用于蝕刻銅箔制造電路板。從蝕刻后的廢液中可以回收銅并使蝕刻液再生。流程如下(部分物質有省略):

回答下列問題:
(1)氯化鐵溶液蝕刻銅箔反應的離子方程式為_______________________________________。
(2)從固體中分離出銅,加入的試劑X可以是________________。
(3)使濾液再生為蝕刻液可采用的方法是___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A.Fe與稀鹽酸反應:2Fe+6H+=2Fe3++3H2↑
B.向K2CO3溶液中通入過量SO2:CO![]() +2SO2+H2O=CO2+2HSO
+2SO2+H2O=CO2+2HSO![]()
C.在強堿溶液中NaClO與FeCl3反應生成Na2FeO4:3ClO-+2Fe3++5H2O=2 FeO![]() +3Cl-+10H+
+3Cl-+10H+
D.用新制的Cu(OH)2檢驗乙醛中的醛基:CH3CHO+Cu(OH)2+OH-![]() CH3COO-+Cu+2H2O
CH3COO-+Cu+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】小穎同學用如圖所示裝置研究原電池原理,下列說法錯誤的是( )

A.若將圖1裝置的Zn、Cu直接接觸,Cu片上能看到氣泡產生
B.圖2裝置中![]() 向Cu片移動
向Cu片移動
C.若將圖2中的Zn片改為Mg片,Cu片上產生氣泡的速率加快
D.圖2與圖3中正極生成物的質量比為1:32時,Zn片減輕的質量相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com