

 2NH3(g)△H<0
2NH3(g)△H<0
 2NH3(g)△H<0為放熱反應,氮氣的轉化率下降,縮短了到達平衡的時間,有可能。因為加入催化劑能縮短達到平衡的時間,但化學平衡不移動,所以b、a兩條件下達到平衡使N2的濃度相同。
2NH3(g)△H<0為放熱反應,氮氣的轉化率下降,縮短了到達平衡的時間,有可能。因為加入催化劑能縮短達到平衡的時間,但化學平衡不移動,所以b、a兩條件下達到平衡使N2的濃度相同。 2NH3(g)△H<0為放熱反應,升高溫度,平衡逆向移動,K會減小;②平衡時,各物質的量不變,所以A.容器內NH3的濃度保持不變,正確。C.容器內壓強保持不變,正確。B.3v(N2)(正)=v(H2)(逆),錯誤。D.由于是恒容容器,總質量、總體積均不變,混合氣體的密度保持不變,錯誤。
2NH3(g)△H<0為放熱反應,升高溫度,平衡逆向移動,K會減小;②平衡時,各物質的量不變,所以A.容器內NH3的濃度保持不變,正確。C.容器內壓強保持不變,正確。B.3v(N2)(正)=v(H2)(逆),錯誤。D.由于是恒容容器,總質量、總體積均不變,混合氣體的密度保持不變,錯誤。

科目:高中化學 來源:不詳 題型:單選題
| A.常溫常壓下單斜硫比正交硫穩定 |
B.單斜硫轉變為正交硫的能量變化可用下圖表示 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反應①中生成1 L SO2 (g)放出297.16kJ熱量 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
 H++ SO42-
H++ SO42- 的廢水會發生如下反應:
的廢水會發生如下反應: Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
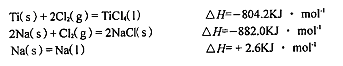
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1  SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。

 CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如上圖(右)所示。該反應?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同溫度下的平衡轉化率與壓強的關系如上圖(右)所示。該反應?H 0(填“>”或“ <”)。 查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題
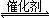 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H
 HSO3—的平衡常數K="8.0" × 106 L?mol-1,計算時SO2、H2SO3的濃度忽略不計)
HSO3—的平衡常數K="8.0" × 106 L?mol-1,計算時SO2、H2SO3的濃度忽略不計)查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 向
向 的轉化,請你提出一條可行性建議 。
的轉化,請你提出一條可行性建議 。 2CO2+N2。
2CO2+N2。 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1| 時間/s | 0 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 1.00×10-3 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 | |  |  2.70×10-3 2.70×10-3 | |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com