
(I)某化學家根據(jù)“原子經(jīng)濟”的思想,設(shè)計了如下制備H2的反應步驟:
①CaBr2+H2O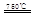 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg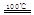 HgBr2+H2
HgBr2+H2
③HgBr2+_____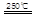 _____ + ④2HgO
_____ + ④2HgO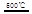 2Hg+O2↑
2Hg+O2↑
請你根據(jù)“原子經(jīng)濟”的思想完成上述步驟③的化學方程式:________ _。
根據(jù)“綠色化學”的思想評估該方法制H2的主要缺點:________ __。
(II)氫氣常用生產(chǎn)水煤氣的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃時,K=1。
(1)若升高溫度到950℃時,達到平衡時K______1(填“大于”、“小于”或“等于”)
(2)850℃時,若向一容積可變的密閉容器中同時充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,則:
①當x = 5.0時,上述平衡向___________(填正反應或逆反應)方向進行。
②若要使上述反應開始時向正反應方向進行,則x應滿足的條件是__________。
(3)在850℃時,若x="5.0" mol,其它物質(zhì)的投料不變,當上述反應達到平衡后,求H2的體積分數(shù)(計算結(jié)果保留兩位有效數(shù)字)。
(16分)
(I)HgBr2+CaO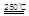 HgO+CaBr2(3分)
HgO+CaBr2(3分)
循環(huán)過程需要很高的能量,且使用重金屬汞,會產(chǎn)生污染(3分)
(II)(1)小于(2分) (2) ①逆反應 (1分) ② 0≤x<3 (2分)
(3)解:設(shè)到達平衡時,H2或CO2減少amol,則CO、H2O增加amol,則:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
初始物質(zhì)的量/mol 1.0 3.0 1.0 5.0
變化物質(zhì)的量/mol a a a a
平衡物質(zhì)的量/mol 1.0+a 3.0+a 1.0-a 5.0-a (2分)
K=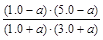 =1,解得a=0.20 (1分)
=1,解得a=0.20 (1分)
平衡時H2的體積分數(shù)=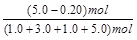 ×100% = 48% (2分)
×100% = 48% (2分)
解析試題分析:(I)依題意,①的生成物是②的反應物,②的生成物是③的反應物,③的生成物是④的反應物,④的反應物是HgO,則③的生成物是HgO,根據(jù)質(zhì)量守恒定律可知,③的另一種反應物和生成物分別是CaO、CaBr2;(①+②+③)×2+④可得:2H2O=2H2↑+O2↑;上述4個反應都需要加熱,因此消耗很多的能量才能循環(huán)制氫;上述過程中使用Hg、可溶性汞鹽,它們屬于重金屬或重金屬鹽,則制氫過程能產(chǎn)生污染;II.(1)△H<0,說明正反應是放熱反應;其它條件不變時,升高溫度平衡向吸熱反應方向移動,即850℃變?yōu)?50℃時,平衡向逆反應方向移動,平衡常數(shù)減小,則K<1;(2)①依題意,起始時,生成物濃度冪之積與反應物濃度冪之積的比值為(1.0×5.0)/(1.0×3.0)=5/3,大于該溫度下的平衡常數(shù),說明起始時反應從逆反應方向開始進行,使生成物濃度減小、反應物濃度增大,當生成物濃度冪之積與反應物濃度冪之積的比值為1時,達到850℃時的化學平衡;②若起始時,生成物濃度冪之積與反應物濃度冪之積的比值小于1,即(1.0×x)/(1.0×3.0)<1,則0≤x<3.0;(3)設(shè)到達平衡時,H2或CO2減少amol,則CO、H2O增加amol,則:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始物質(zhì)的量/mol 1.0 3.0 1.0 5.0
變化物質(zhì)的量/mol a a a a
平衡物質(zhì)的量/mol 1.0+a 3.0+a 1.0-a 5.0-a
K=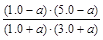 =1,解得a=0.20
=1,解得a=0.20
平衡時H2的體積分數(shù)=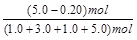 ×100% = 48%。
×100% = 48%。
考點:考查化學反應原理,涉及化學方程式的配平、化學實驗方案的評價、溫度對平衡移動的影響、可逆反應進行的方向、化學平衡常數(shù)的計算等。


科目:高中化學 來源: 題型:問答題
(16分)高鐵酸鈉(Na2FeO4)具有很強的氧化性,廣泛應用于凈水、電池工業(yè)等領(lǐng)域。以粗FeO(含有CuO、Al2O3和SiO2等雜質(zhì))制備高鐵酸鈉的生產(chǎn)流程如下,回答下列問題: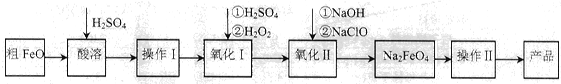
已知:NaClO不穩(wěn)定,受熱易分解。
(1)粗FeO酸溶過程中通入水蒸氣(高溫),其目的是__________________________。
(2)操作I目的是得到高純度FeSO4溶液,則氧化I中反應的離子方程式為_________。
(3)本工藝中需要高濃度NaClO溶液,可用Cl2與NaOH溶液反應制備
①Cl2與NaOH溶液反應的離子方程式為_________________。
②在不同溫度下進行該反應,反應相同一段時間后,測得生成NaClO濃度如下:
| 溫度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO濃度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
把0.4 mol X氣體和0.6 mol Y氣體混合于2 L密閉容器中,使它們發(fā)生如下反應:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末測得容器內(nèi)的壓強變?yōu)樵瓉韷簭姷?.05倍,且測知前2min內(nèi)以Z的濃度變化表示的反應速率為0.05 mol·(L·min)-1。
求:(1)前2 min內(nèi)用X的濃度變化表示的平均反應速率?
(2)2min末Y的濃度?
(3)化學反應方程式中n的值?
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
甲醇可作為燃料電池的原料。以CH4和H2O為原料,通過下列反應來制備甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
(1)CH4(g)與H2O(g)反應生成CH3OH(g)和H2(g)的熱化學方程式為 。
(2)將1.0mol CH4和1.0mol H2O(g)通入容積為100 L的反應室,在一定條件下發(fā)生反應I,測得在一定的壓強下CH4的轉(zhuǎn)化率與溫度的關(guān)系如圖。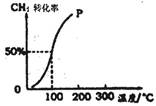
①假設(shè)100℃時達到平衡所需構(gòu)時間為5min,則用H2表示該反應的平均反應速率為 。
②1000C時反應I的平衡常數(shù)為 。
(3)在壓強為0.1 MPa、溫度為300℃條件下,將a molCO與2a mol H2的混合氣體在催化劑作用下發(fā)生反應II生成甲醇,平衡后將容器舶容積壓縮到原來的1/2,其他條件不變,對平衡體系產(chǎn)生的影響是 (填字母序號)。
| A.平衡常數(shù)K增大 | B.正反應速率加快,逆反應速率減慢 |
| C.CH3OH的物質(zhì)的量增加 | D.重新平衡c(H2)/c(CH3OH)減小 |

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
碳及其化合物有廣泛的用途。
(1)將水蒸氣通過紅熱的碳即可產(chǎn)生水煤氣。反應為:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反應達到平衡后,在體積不變的條件下,以下措施有利于提高H2O的平衡轉(zhuǎn)化率的是 。(填序號)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反應達到平衡后,在體積不變的條件下,以下措施有利于提高H2O的平衡轉(zhuǎn)化率的是 。(填序號)
| A.升高溫度 | B.增加碳的用量 | C.加入催化劑 | D.用CO吸收劑除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的焓變△H=
CO2(g)+H2(g)的焓變△H=  CH3OH(g)。甲醇是一種燃料,可利用甲醇設(shè)計一個燃料電池,用稀硫酸作電解質(zhì)溶液,多孔石墨做電極,該電池負極反應式為: 。
CH3OH(g)。甲醇是一種燃料,可利用甲醇設(shè)計一個燃料電池,用稀硫酸作電解質(zhì)溶液,多孔石墨做電極,該電池負極反應式為: 。 CO(g)+H2O(g) CO2(g)+H2(g),得到如下數(shù)據(jù):
CO(g)+H2O(g) CO2(g)+H2(g),得到如下數(shù)據(jù):| 溫度/℃ | 起始量/mol | 平衡量/mol[學科 | 達到平衡所x需時間/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。實驗室模擬化工生產(chǎn),分別在不同實驗條件下反應,N2濃度隨時間變化如下圖。
2NH3(g) ΔH=-92.4kJ?mol-1。實驗室模擬化工生產(chǎn),分別在不同實驗條件下反應,N2濃度隨時間變化如下圖。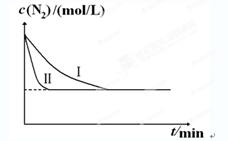

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。該反應可用于消除氮氧化物的污染。在130℃和180℃時,分別將0.50 molCH4和a molNO2充入1L的密閉容器中發(fā)生反應,測得有關(guān)數(shù)據(jù)如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。該反應可用于消除氮氧化物的污染。在130℃和180℃時,分別將0.50 molCH4和a molNO2充入1L的密閉容器中發(fā)生反應,測得有關(guān)數(shù)據(jù)如下表:
| 實驗編號 | 溫度 | 時間 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |

 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
氨基甲酸銨(NH2COONH4)是一種白色固體,易分解、易水解,可用做肥料、滅火劑、洗滌劑等。某化學興趣小組模擬制備氨基甲酸銨,并探究其分解反應平衡常數(shù)。反應的化學方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。請按要求回答下列問題:
NH2COONH4(s)。請按要求回答下列問題:
(1)請在下圖1方框內(nèi)畫出用濃氨水與生石灰制取氨氣的裝置簡圖。
(2)制備氨基甲酸銨的裝置如下圖2所示。生成的氨基甲酸銨小晶體懸浮在四氯化碳中。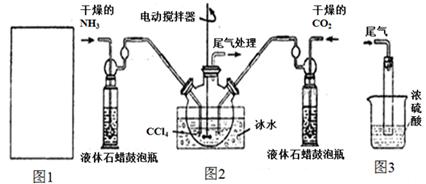
①從反應后的混合物中分離出產(chǎn)品的實驗方法是_____________(填操作名稱)。
②上圖3中濃硫酸的作用是_______________________________________。
(3)將一定量純凈的氨基甲酸銨固體置于特制的密閉真空容器中(假設(shè)容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡。實驗測得不同溫度下的平衡數(shù)據(jù)列于下表:
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述或表示正確的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,則a+1=b |
| B.用200 mL 4 mol·L-1的NaOH溶液將0.6 mol CO2完全吸收,反應的離子方程式為: 3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
| C.難溶電解質(zhì)AB2的飽和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,則Ksp值為4xy2 |
| D.常溫下0.1 mol·L-1的醋酸溶液與等濃度等體積NaOH溶液反應后的溶液中: |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com