
【題目】一定溫度下,在容積可變的恒壓容器中,反應2NO2(g)N2O4(g)達到平衡后,再向容器內通入一定量NO2,再次達到平衡時,N2O4的體積分數( )
A.不變 B.增大 C.減小 D.無法判斷
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. 用燒杯可以精確配制0.1 mol·L-1的NaOH溶液
B. 用淀粉溶液檢驗某溶液中是否存在碘單質
C. 可利用丁達爾效應區分膠體與溶液
D. 用苯可以萃取溴水中的溴單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種化學性質活潑的氣體。(1)新制備的氯水呈淺黃綠色,說明氯水中有 分子存在(寫化學式)。向氯水中滴入幾滴AgNO3溶液,現象是 。
(2)如圖所示,將氯氣依次通過盛有干燥有色布條的廣口瓶和盛有潮濕有色布條的廣口瓶,可觀察的現象是 。
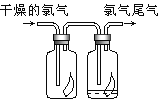
(3)為防止氯氣污染空氣,可用 溶液吸收多余的氯氣,該反應的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗誤差分析錯誤的是( )
A. 用濕潤的pH試紙測稀堿液的pH,測定值偏小
B. 用容量瓶配置溶液,定容時俯視刻度線,所配溶液濃度偏小
C. 滴定前滴定管內無氣泡,終點讀數時有氣泡,所測體積偏小
D. 測定中和反應反的應熱時,將堿緩慢倒入酸中,所測溫度值偏小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列框圖回答問題(答題時方程式中的M、E用所對應的元素符號表示):

(1)寫出M、E的化學式:M ;E ;
(2)M溶于稀H2SO4和H2O2混合液的化學方程式: ,若參加反應H2O2為1mol,轉移電子為 mol。
(3)某同學取X的溶液,用稀硫酸酸化并在空氣中放置一段時間后,加入KI—淀粉溶液,溶液變為藍色。寫出與上述變化過程相關的離子方程式: 、 。
(4)寫出Cl2將Z氧化為K2EO4的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物在能源、材料等方面具有廣泛的用途。回答下列問題:
(1)碳酸和草酸均為二元弱酸,其電離分為兩步進行,已知其電離常數的有關數據如下表:向Na2CO3溶液中滴加草酸溶液,開始時所發生反應的離子方程式為 。
H2CO3 | H2C2O4 | |
K1 | 4.2×10-7 | 5.4×10-2 |
K2 | 5.6×10-11 | 5.4×10-5 |
(2)常溫時,C和CO的燃燒熱△H分別為-394.0 kJ·mol-1、-283.0 kJ·mol-1,該條件下C轉化為CO的熱化學方程式為 。
(3)氫氣和一氧化碳在一定條件下可合成甲醇,反應如下
2H2(g)+CO(g)![]() CH3OH(g) △H=Q kJ·mol-1。
CH3OH(g) △H=Q kJ·mol-1。
①該反應在不同溫度下的化學平衡常數(K)如下表:
溫度(℃) | 250 | 300 | 350 |
K(L2·mol-1) | 2.041 | 0.270 | 0.012 |
由此可判斷Q 0(填“>”、“=”或“<”)
②一定溫度下,將6 mol H2和2mol CO充入到體積為2 L的密閉容器中,10 min時反應達到平衡狀態,此時測得c(CO)=0.2 mol·L-1,該溫度下的平衡常數K= 。0~10 min內,反應速率v(CH3OH)= 。
③在兩個密閉容器中分別都充入20 mol H2和10 mol CO,測得一氧化碳的平衡轉化率隨溫度(T)、壓強(p)的變化如下圖所示:
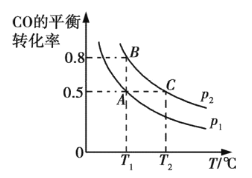
A、B兩點壓強大小關系:p1 p2(填“>”、“=”或“<”)。若A點對應容器的容積為20 L,則B點對應的容器的容積為 L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于常見有機物的說法正確的是
A. 淀粉水解與纖維素水解得到的最終產物不相同
B. 蛋白質、纖維素、蔗糖、油脂都是高分子化合物
C. 乙酸和油脂都能與NaOH溶液反應
D. 乙醇、乙酸和乙酸乙酯不能用飽和Na2CO3溶液鑒別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把amolNH3、O2組成的混合氣充入密閉反應器中,在一定條件下發生化學反應。若混合氣中O2的物質的量為x,生成HNO3的物質的量為y。試確定x在不同取值范圍時y=f(x)的函數表達式,并畫出函數的圖象。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com