
【題目】某氯化鎂溶液的密度為1.18g·mL-1,其中鎂離子的質量分數為5.1%。300mL該溶液中Cl—的物質的量約為
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下圖中的曲線分別表示元素的某種性質與核電荷數的關系(Z為核電荷數,Y為元素的有關性質):
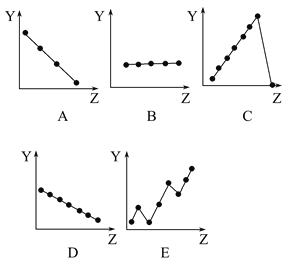
把與元素有關性質相符的曲線的標號填入相應括號中:
(1)ⅡA族元素原子的價電子數___________;
(2)第三周期元素的最高正化合價___________;
(3)F-、Na+、Mg2+、Al3+四種離子的離子半徑___________;
(4)第二周期元素的原子半徑(不包括稀有氣體) ___________;
(5)第二周期元素的第一電離能 ___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是有色金屬,被廣泛地應用于電氣、輕工、機械制造、建筑工業、國防工業等領域,銅的冶煉和加工對于現代社會有著重要的意義。
(1)工業上可用黃銅礦冶煉粗銅,簡要流程如下:
![]()
在轉爐中,經過兩步反應生成粗銅,其的熱化學方程式分別為:
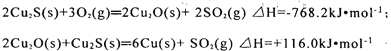
則總反應的熱化學方程式為:_______________________________________;
(2)粗銅可用電解法精煉,電解過程中,粗銅應做____極;精銅一側電極反應式為__________;
(3)電解精煉時粗銅中Fe、Zn等雜質元素會進入電解質溶液,一段時間后需要對電解液除雜凈化,其中除去鐵元素的一種操作如下:
![]()
下表為部分陽離子以氫氧化物形式沉淀時溶液的pH:

①試劑a是_______________,其作用是_________________________________________;
②溶液A加入CuO調節pH的目的是________________________________________(用必要的離子方程式和適當的文字說明)。
③操作①名稱是________________。
(4)電解槽陽極泥中含有Ag、Au等貴金屬,分離提純Au的工藝流程如下:
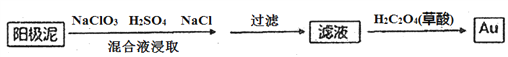
①濾液中Au元素的存在形式為[AuC14]-,寫出浸取步驟反應的離子方程式________________。
②加入草酸后,濾液中發生氧化還原反應,生成Au單質,該反應中氧化劑和還原劑的物質的量之比為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用于金屬焊接的某種焊條,其藥皮由大理石、水泥、硅鐵等配制而成。
(1)Al的原子結構示意圖為________;Al與NaOH溶液反應的離子方程式為_________________________________________________________________。
(2)30Si原子的中子數為________;SiO2的晶體類型為________。
(3)Al3+與Yn-的電子數相同,Y所在族各元素的氫化物的水溶液均顯酸性,則該族氫化物中沸點最低的是________。
(4)焊接過程中,藥皮在高溫下產生了熔渣和使金屬不被氧化的氣體,該氣體是________。
(5)經處理后的熔渣36.0 g(僅含Fe2O3、Al3O3、SiO2),加入足量稀鹽酸,分離得到11.0 g固體;濾液中加入過量NaOH溶液,分離得到21.4 g固體;則此熔渣中Al2O3的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 常溫常壓下,1molCO2中含有的原子數為3×6.02×1023
B. 用激光筆照射CuCl2溶液可產生“丁達爾效應”
C. 常溫下,鐵片能溶于濃硫酸
D. Na在空氣中燃燒時發出耀眼的白光,可用于制造信號彈
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性氫氧燃料電池電解粗鹽水(含Na+、Cl-和少量Mg2+、Br-)的裝置如圖所示(a、b均為石墨電極),下列說法正確的是

A. 電池工作時,負極反應式為:H2-2e-+2OH-=2H2O
B. a極的電極反應式為:2H++2e-=H2↑
C. 電解過程中電子流動路徑是:負極→外電路→陰極→溶液→陽極→正極
D. 當電池中消耗2.24 L(標準狀況下)H2時,b極周圍會產生0.1 mol氣體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com