
【題目】用酸性氫氧燃料電池電解粗鹽水(含Na+、Cl-和少量Mg2+、Br-)的裝置如圖所示(a、b均為石墨電極),下列說法正確的是

A. 電池工作時,負極反應式為:H2-2e-+2OH-=2H2O
B. a極的電極反應式為:2H++2e-=H2↑
C. 電解過程中電子流動路徑是:負極→外電路→陰極→溶液→陽極→正極
D. 當電池中消耗2.24 L(標準狀況下)H2時,b極周圍會產生0.1 mol氣體
 作業輔導系列答案
作業輔導系列答案科目:高中化學 來源: 題型:
【題目】下列有關原子結構和元素周期律表述正確的是
A. ⅦA族元素是同周期中非金屬性最強的元素
B. 原子序數為15的元素的最高化合價為+3
C. 原子序數為12的元素位于元素周期表的第三周期ⅡA族
D. 第二周期ⅣA族元素的原子核電荷數和中子數一定為6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是部分短周期中第二、第三周期元素的原子半徑及主要化合價。
元素代號 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半徑(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合價 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列問題:
(1)⑧在元素周期表中的位置是(周期、族)____________________。
(2)8個元素的最高價氧化物的水化物中,酸性最強的是___________________(填化學式)。
(3)①元素和⑥元素形成化合物的電子式是 ___________________________ 。
(4)寫出④最高價氧化物對應水化物與⑥的氫化物水溶液反應的離子方程式:_______________________________________________ 。
(5)下列敘述正確的是______________(填字母)。
A.③、④處于不同周期
B.②的陽離子與⑧的陰離子的核外電子數相等
C.⑥在同主族元素中非金屬性最強
D.⑤元素與⑦元素兩者核電荷數之差是8
E.①與⑧形成的化合物具有兩性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某氯化鎂溶液的密度為1.18g·mL-1,其中鎂離子的質量分數為5.1%。300mL該溶液中Cl—的物質的量約為
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】判斷含氧酸強弱的一條經驗規律:含氧酸分子結構中含非羥基氧原子數越多,該含氧酸的酸性越強。幾種實例如下表所示。
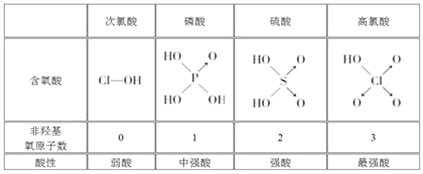
(1)亞磷酸(H3PO3)和亞砷酸(H3AsO3)的分子式相似,但它們的酸性差別很大。亞磷酸是中強酸,亞砷酸既有弱酸性又有弱堿性,由此可推出它們的結構式分別為:亞磷酸______________________,亞砷酸________________________。
(2)亞磷酸和亞砷酸與過量的NaOH溶液反應的化學方程式分別是:
亞磷酸:______________________________________,
亞砷酸:_______________________________________。
(3)在亞磷酸和亞砷酸中分別加入濃鹽酸,分析反應情況,寫出化學方程式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組取一定質量的鎂鋁合金材料投入200 mL稀硫酸中,待固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量(n)與加入NaOH溶液體積(V)的關系如圖所示。
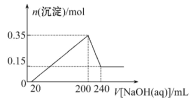
請回答下列問題:
(1)加入NaOH溶液0~20 mL時,發生反應的離子方程式為__________________________。
(2)加入NaOH溶液體積為220 mL時,沉淀的成分是________________________________。
(3)該合金材料中,鎂、鋁的物質的量之比為________________________。
(4)稀硫酸的物質的量濃度為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中實線是元素周期表的部分邊界,其中上邊界并未用實線畫出.
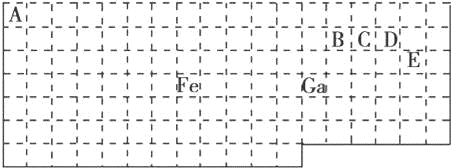
根據信息回答下列問題:
(1)基態Ga原子的最外層電子排布式為
(2)鐵元素位于元素周期表的 區;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中鐵的化合價為 .
(3)已知:原子數目和價電子總數均相同的微粒互為等電子體,等電子體具有相似的結構特征.與CO互為等電子體的分子和離子分別為 和 (填化學式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3雜化的分子有 .
(5)根據VSEPR模型預測ED4﹣的空間構型為 .B、C、D、E原子相互化合形成的分子中,所有原子都滿足最外層8電子穩定結構的分子為 (寫2種).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉、鋁、鐵是三種重要的金屬。請回答:
(1)鈉元素的金屬活動性比鋁的________(填“強”或“弱”)。
(2)將一小塊金屬鈉投入水中,發生反應的離子方程式為____________;可觀察到的實驗現象是________(填序號)。
a.鈉沉到水底 b.鈉熔成小球 c.小球四處游動
(3)呼吸面具的原理:________________,_______________________。
(4)填寫a、b、c化學式并書寫①、②的離子方程式(a、b、c均為含Al化合物);
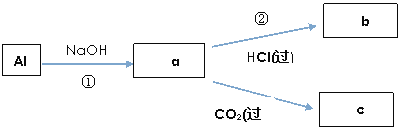
a:____________,b:_____________,c:____________;
①____________________________________________;
②____________________________________________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com