
Ⅰ.電離平衡常數(用K表示)的大小可以判斷電解質的相對強弱。25℃時,有關物質的電離平衡常數如下表所示:
|
化學式 |
HF |
H2CO3 |
HClO |
|
電離平衡常數 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物質的量濃度均為0.1mol/L的下列四種溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依據數據判斷pH由大到小的順序是______________。
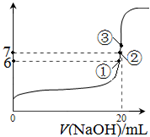
(2)25℃時,在20mL0.1mol·L—1氫氟酸中加入VmL0.1mol·L—1NaOH溶液,測得混合溶液的pH變化曲線如圖所示,下列說法正確的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水電離出的c(H+)相等
B.①點時pH=6,此時溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②點時,溶液中的c(F-)=c(Na+)
D.③點時V=20mL,此時溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃時,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氫氟酸的電離方程式及熱效應可表示為________________________。
(4)長期以來,一直認為氟的含氧酸不存在。1971年美國科學家用氟氣通過細冰末時獲得HFO,其結構式為H—O—F。HFO與等物質的量的H2O反應得到HF和化合物A,則每生成1molHF轉移_______mol電子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化劑。它是一種無色液體,熔點–54.1℃,沸點69.1℃。氯化硫酰可用干燥的二氧化硫和氯氣在活性炭催化劑存在下反應制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)試寫出常溫常壓下化學平衡常數K的表達式:K=_________________;
(2)對上述反應,若要使化學平衡常數K增大,化學反應速率v正也增大,可采取的措施是_____(選填編號)。
a.降低溫度 b.移走SO2Cl2
c.增加反應物濃度 d.無法滿足上述條件
(3)下列描述中能說明上述反應已達平衡的是____________(選填編號)。
a.υ(Cl 2)=υ(SO2) b.容器中氣體壓強不隨時間而變化
c.c(Cl 2) : c(SO2)=1:1 d.容器中氣體顏色不隨時間兩變化
(4)300℃時,體積為1L的密閉容器中充入16.20g SO2Cl2,達到平衡時容器中含SO2 7.616g。若在上述中的平衡體系中,再加入16.20g SO2Cl2,當再次達平衡時,容器中含SO2的質量范圍是________________________。
Ⅰ. (1)①④②③(或①>④>②>③,用物質名稱表示也對)(2分) (2)BC(2分)
(3)HF(aq) 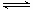 H+(aq)
+F—(aq) △H=-(a-b)KJ·mol—1(2分,不寫可逆號扣1分)
H+(aq)
+F—(aq) △H=-(a-b)KJ·mol—1(2分,不寫可逆號扣1分)
(4)1(2分)
Ⅱ.(1)K=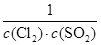 (2分) 2)d(2分)(3)bd(2分)
(2分) 2)d(2分)(3)bd(2分)
(4)7.616g<m(SO2)<15.232g(2分)
【解析】
試題分析:Ⅰ.(1)根據越弱越水解,電離常數越小,鹽水解時堿性越強,碳酸的二級電離常數最小,所以①堿性最強,其次是④,再次是②,最小是③;(2)A、HF溶液中對水的電離起抑制作用,NaF溶液中對水的電離起促進作用,因此由水電離出的c(H+)不相等,錯誤;B、①點時pH=6,根據電荷守恒C(Na+)+C(H+)=C(F-)+C(OH-),c(F-)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7mol/L,正確;C、②點時,pH=7,溶液呈中性,C(H+)=C(OH-),因此溶液中的c(F-)=c(Na+),正確;D、③點時V=20mL,恰好完全反應得到NaF溶液,c(F-)<c(Na+)=0.05mol·L—1,錯誤,選擇BC;(3)根據蓋斯定律,①-②可得HF(aq) 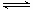 H+(aq)
+F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金屬性強,共用電子對偏向它,帶負電荷-1,H帶正電荷+1,O顯0價,HFO+H2O=HF+H2O2,生成1molHF轉移1摩爾電子。Ⅱ.(2)該反應是放熱反應,要使K增大,只能降低溫度,降溫反應速率降低,所以選d;(3)a、υ(Cl 2)=υ(SO2)在任何條件下都相等,錯誤;b、方程左右兩邊氣體分子系數差不等0,所以壓強不再改變說明氣體物質的量不再變化,達到平衡,正確;c、二者濃度1:1,不能說明它的濃度不再發生變化,錯誤;d、氯氣有顏色,顏色不變,說明濃度不再發生變化,說明達到平衡,正確。(4)平衡體系中,再加入16.20g SO2Cl2,濃度變為原來的2倍,等于增大壓強,平衡正向移動,但是不能抵消改變,所以比原來的大,但比2倍的少,7.616g<m(SO2)<15.232g
H+(aq)
+F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金屬性強,共用電子對偏向它,帶負電荷-1,H帶正電荷+1,O顯0價,HFO+H2O=HF+H2O2,生成1molHF轉移1摩爾電子。Ⅱ.(2)該反應是放熱反應,要使K增大,只能降低溫度,降溫反應速率降低,所以選d;(3)a、υ(Cl 2)=υ(SO2)在任何條件下都相等,錯誤;b、方程左右兩邊氣體分子系數差不等0,所以壓強不再改變說明氣體物質的量不再變化,達到平衡,正確;c、二者濃度1:1,不能說明它的濃度不再發生變化,錯誤;d、氯氣有顏色,顏色不變,說明濃度不再發生變化,說明達到平衡,正確。(4)平衡體系中,再加入16.20g SO2Cl2,濃度變為原來的2倍,等于增大壓強,平衡正向移動,但是不能抵消改變,所以比原來的大,但比2倍的少,7.616g<m(SO2)<15.232g
考點:考查鹽的水解、酸堿中和、熱方程的書寫、化學反應原理


科目:高中化學 來源: 題型:
| 酸 | 點解方程式 | 電離平衡常數 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ |
K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| cα2 |
| 1-α |
| cα2 |
| 1-α |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列說法正確的是
,下列說法正確的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化學 來源: 題型:
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年北京市石景山區高三第一學期期末考試化學試卷(解析版) 題型:填空題
電離平衡常數(用Ka表示)的大小可以判斷電解質的相對強弱。25℃時,有關物質的電離平衡常數如下表所示:
|
化學式 |
HF |
H2CO3 |
HClO |
|
電離平衡常數 (Ka) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)已知25℃時,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氫氟酸的電離方程式及熱效應可表示為________________________。
(2)將濃度為0.1 mol/LHF溶液加水稀釋一倍(假設溫度不變),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C. D.
D.
(3)25℃時,在20mL0.1mol/L氫氟酸中加入VmL0.1mol/LNaOH溶液,測得混合溶液的pH變化曲線如圖所示,下列說法正確的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水電離出的c(H+)相等
B.①點時pH=6,此時溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②點時,溶液中的c(F—)=c(Na+)
D.③點時V=20mL,此時溶液中c(F—)< c(Na+)=0.1mol/L
(4)物質的量濃度均為0.1mol/L的下列四種溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依據數據判斷pH由大到小的順序是______________。
(5)Na2CO3溶液顯堿性是因為CO32—水解的緣故,請設計簡單的實驗事實證明之
___________________________________________________________。
(6)長期以來,一直認為氟的含氧酸不存在。1971年美國科學家用氟氣通過細冰末時獲得HFO,其結構式為H—O—F。HFO與水反應得到HF和化合物A,每生成1molHF轉移 mol電子。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com