
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列說法正確的是
,下列說法正確的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1| 1 |
| c(SO2).c(Cl2) |
| 1 |
| c(SO2).c(Cl2) |


科目:高中化學 來源: 題型:
| 酸 | 點解方程式 | 電離平衡常數 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ |
K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| cα2 |
| 1-α |
| cα2 |
| 1-α |
查看答案和解析>>
科目:高中化學 來源:2010年廣東省執信中學高二上學期期中考試化學卷 題型:填空題
對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系.下表是25℃時幾種常見弱酸的電離平衡常數
| 酸 | 電離方程式 | 電離平衡常數K |
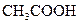 | 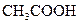  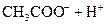 |  |
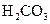 |  | 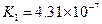 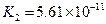 |
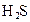 | 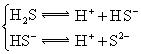 | 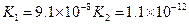 |
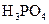 | 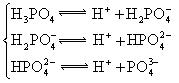 | 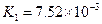 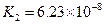 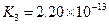 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年河南省商丘市高三第二次模擬考試理綜化學試卷(解析版) 題型:填空題
Ⅰ.電離平衡常數(用K表示)的大小可以判斷電解質的相對強弱。25℃時,有關物質的電離平衡常數如下表所示:
|
化學式 |
HF |
H2CO3 |
HClO |
|
電離平衡常數 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物質的量濃度均為0.1mol/L的下列四種溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依據數據判斷pH由大到小的順序是______________。
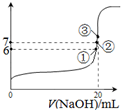
(2)25℃時,在20mL0.1mol·L—1氫氟酸中加入VmL0.1mol·L—1NaOH溶液,測得混合溶液的pH變化曲線如圖所示,下列說法正確的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水電離出的c(H+)相等
B.①點時pH=6,此時溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②點時,溶液中的c(F-)=c(Na+)
D.③點時V=20mL,此時溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃時,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氫氟酸的電離方程式及熱效應可表示為________________________。
(4)長期以來,一直認為氟的含氧酸不存在。1971年美國科學家用氟氣通過細冰末時獲得HFO,其結構式為H—O—F。HFO與等物質的量的H2O反應得到HF和化合物A,則每生成1molHF轉移_______mol電子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化劑。它是一種無色液體,熔點–54.1℃,沸點69.1℃。氯化硫酰可用干燥的二氧化硫和氯氣在活性炭催化劑存在下反應制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)試寫出常溫常壓下化學平衡常數K的表達式:K=_________________;
(2)對上述反應,若要使化學平衡常數K增大,化學反應速率v正也增大,可采取的措施是_____(選填編號)。
a.降低溫度 b.移走SO2Cl2
c.增加反應物濃度 d.無法滿足上述條件
(3)下列描述中能說明上述反應已達平衡的是____________(選填編號)。
a.υ(Cl 2)=υ(SO2) b.容器中氣體壓強不隨時間而變化
c.c(Cl 2) : c(SO2)=1:1 d.容器中氣體顏色不隨時間兩變化
(4)300℃時,體積為1L的密閉容器中充入16.20g SO2Cl2,達到平衡時容器中含SO2 7.616g。若在上述中的平衡體系中,再加入16.20g SO2Cl2,當再次達平衡時,容器中含SO2的質量范圍是________________________。
查看答案和解析>>
科目:高中化學 來源:2010年廣東省高二上學期期中考試化學卷 題型:填空題
對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系.下表是25℃時幾種常見弱酸的電離平衡常數
|
酸 |
電離方程式 |
電離平衡常數K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
回答下列各問:
(1)K只與溫度有關,當溫度升高時,K值________(填“增大”、“減小”、“不變”).
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最強的是_________,最弱的是________.
(4)多元弱酸是分步電離的,每一步都有相應的電離平衡常數.對于同一種多元弱酸的K1、K2、K3之間存在著數量上的規律,對于H3PO4此規律是________________,產生此規律的原因是_________________________.
 (5)電離平衡常數是用實驗的方法測定出來的.現已經測得某溫度下 NH3∙H2O溶液中存在如下反應:NH3∙H2O NH4++OH-
已知0.10 mol·L-1
NH3∙H2O溶液中,達到平衡時,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的電離可忽略不計;
(5)電離平衡常數是用實驗的方法測定出來的.現已經測得某溫度下 NH3∙H2O溶液中存在如下反應:NH3∙H2O NH4++OH-
已知0.10 mol·L-1
NH3∙H2O溶液中,達到平衡時,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的電離可忽略不計;
①用pH試紙測量溶液的pH值,即可求得C平衡(OH-),測定溶液pH值的操作是______________。
②測量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名稱)
③求此溫度下該反應的平衡常數K.(寫出計算過程,計算結果保留2位有效數字)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com