
【題目】掌握儀器名稱、組裝及使用方法是中學化學實驗的基礎,如圖為兩套實驗裝置。
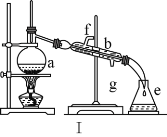
(1)寫出下列儀器的名稱:a.____,b._____,c.____。
(2)儀器ae中,使用前必須檢查是否漏水的有____(填序號)。
(3)若利用裝置Ⅰ分離四氯化碳和酒精的混合物,溫度計水銀球的位置在____處。冷凝水由(填“f”或“g”,下同)____口通入,_____口流出。
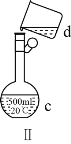
(4)現需配制0.13mol·L1NaOH溶液450mL,裝置Ⅱ是某同學轉移溶液的示意圖。
①根據計算用托盤天平稱取NaOH溶液的質量為_____g。為完成此溶液配制實驗需要的玻璃儀器有______。
②圖Ⅱ中的錯誤是_____。
③配制時,按以下幾個步驟進行:計算、稱量、溶解、冷卻、轉移、定容、搖勻、裝瓶。操作中還缺少一個重要步驟是_____。
④取用任意體積的該NaOH溶液時,下列物理量中不隨所取體積的多少而變化的是_____(填字母)。
A.溶液中Na的物質的量 B.溶液的濃度
C.NaOH的溶解度 D.溶液的密度
⑤下面操作造成所配NaOH溶液濃度偏高的是_____。
A.暴露在空氣中稱量NaOH的時間太長
B.將砝碼放在左盤上, NaOH放在右盤上進行稱量(使用游碼)
C.向容量瓶轉移液體時,容量瓶內含有蒸餾水
D.溶解后未冷卻至室溫就轉移至容量瓶
E.轉移液體時玻璃棒的下端放在容量瓶刻度線以上處
F.定容時,加蒸餾水超過刻度線,又用膠頭滴管吸出
G.定容時俯視刻度線
【答案】蒸餾燒瓶 冷凝管 500mL容量瓶 c 蒸餾燒瓶支管口 g f 2.6 燒杯、玻璃棒、500 mL 容量瓶、膠頭滴管、細口瓶 未用玻璃棒引流 洗滌并轉移 BCD DG
【解析】
(1)蒸餾裝置中的主要儀器有蒸餾燒瓶、冷凝管、牛角管、錐形瓶,酒精燈,根據儀器的結構特點判斷;
(2)容量瓶在使用前一定要查漏;
(3)蒸餾時,溫度計的水銀球要位于蒸餾燒瓶的支管口處;冷凝管下口是進水口,上口是出水口,據此即可解答;
(4)①根據n=cV和m=nM來計算;
②根據配制一定物質的量濃度的溶液的方法和操作來尋找裝置中的錯誤;
③根據配制一定物質的量濃度的溶液的方法,判斷操作步驟;
④取用任意體積的該NaOH溶液時,由于溶液具有均一性,則所取溶液的密度、物質的量濃度都不變,而溶質的物質的量、OH﹣的數目與溶液體積有關;
⑤分析操作對溶質物質的量和溶液體積的影響,依據c=![]() 進行誤差分析。
進行誤差分析。
(1)蒸餾裝置中的主要儀器有蒸餾燒瓶、冷凝管、牛角管、錐形瓶,酒精燈,a為蒸餾燒瓶,b為冷凝管,C為500mL容量瓶;
(2)容量瓶帶有瓶塞,為防止使用過程中漏水,所以在使用前一定要查漏,故答案為:C;
(3)蒸餾試驗中,溫度計測定的是蒸氣溫度,溫度計應位于蒸餾燒瓶支管口處,冷凝水流向與蒸氣流向相反,所以冷凝管下口是進水口,上口是出水口;
(4)①由于無450mL容量瓶,故要選用500ml容量瓶,配制出500mL 0.1mol/L的NaOH溶液,所需的NaOH的物質的量n=cV=0.5L×0.13mol/L=0.065mol,質量m=nM=0.065mol×40g/mol=2.6g;
②配制一定物質的量濃度的溶液是必須用玻璃棒引流,防止液體外濺;
③根據操作過程是計算、稱量、溶解、移液、洗滌、定容、搖勻、裝瓶可知還缺少的操作步驟是洗滌并轉移;
④溶液為均一穩定化合物,取用任意體積的該NaOH溶液時,溶液的濃度和密度不變,而體積不同時溶液中含有的鈉離子的數目和含有溶質NaOH的物質的量一定不同,所以不隨所取體積的多少而變化的是BCD;
⑤A.暴露在空氣中稱量NaOH的時間太長,氫氧化鈉吸收二氧化碳和水,導致稱取固體含有溶質物質的量偏小,溶液濃度偏低,故A錯誤;
B.將砝碼放在左盤上,NaOH放在右盤上進行稱量(使用游碼),導致稱取溶質質量偏小,溶質物質的量偏小,溶液濃度偏低,故B錯誤;
C.向容量瓶轉移液體時,容量瓶內含有蒸餾水,對溶質物質的量和溶液體積都不產生影響,溶液濃度無影響,故C錯誤;
D.溶解后未冷卻至室溫就轉移至容量瓶,冷卻后溶液體積偏小,溶液濃度偏高,故D正確;
E.轉移液體時玻璃棒的下端放在容量瓶刻度線以上處,導致溶液體積偏大,溶液濃度偏低,故E錯誤;
F.定容時,加蒸餾水超過刻度線,又用膠頭滴管吸出,導致部分溶質損耗,溶質物質的量偏小,溶液濃度偏低,故F錯誤;
G.定容時俯視刻度線,導致溶液體積偏小,溶液濃度偏高,故G正確;
故答案為DG。


科目:高中化學 來源: 題型:
【題目】如圖所示,圖Ⅰ是恒壓密閉容器,圖Ⅱ是恒容密閉容器。當其它條件相同時,在Ⅰ、Ⅱ中都分別加入2molX和2molY,開始時容器的體積均為VL,發生如下反應并達到平衡狀態:2X(?)+ Y(?)![]() a Z(g)。
a Z(g)。
此時Ⅰ中X、Y、Z的物質的量之比為1∶3∶2。下列判斷不正確的是
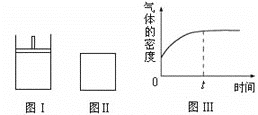
A. 物質Z的化學計量數a =1
B. 若X、Y均為氣態,則在平衡時X的轉化率:Ⅰ>Ⅱ
C. 若Ⅱ中氣體的密度如圖Ⅲ所示,則X、Y中只有一種為氣態
D. 若X為固態、Y為氣態,則Ⅰ、Ⅱ中從開始到平衡所需的時間:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應是化學實驗現象的本質,根據描述回答下列問題:
(1)在BaCl2溶液中通入SO2氣體,未見沉淀生成,若先通入或加入下列的另一種物質,再通入SO2能看到沉淀的有___(填序號)。
①NO2 ②NH3 ③HCl ④FeCl3溶液 ⑤CO2
(2)A、B、C、D、E五種物質(或離子)均含有同一種元素,它們之間有如圖所示的轉化關系:
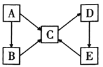
若A為金屬單質,B、C均屬于鹽類,B溶液呈黃色,與硫氰化鉀溶液混合后顯紅色,D是一種白色沉淀,E是一種不溶性堿。B溶液呈酸性的原因是___(用離子方程式表示);選用氫碘酸可與E反應實現E→C的轉化,該反應的離子方程式為___。
(3)①通常條件下,未經碾磨的鎂粉和未經擦拭的鎂條跟冷水不反應,因為表面有一層保護膜。去除這層氧化膜后,鎂與冷水就會發生明顯的反應,看到有大量細膩的氣泡產生。在室溫條件下,反應生成的難溶于水的氫氧化鎂,沉積在表面形成致密薄膜,幾分鐘后,反應很快停止。給反應混合液加熱,鎂跟水的作用又會重新進行,你覺得可能的原因是:___,此時滴加酚酞試液,___(填“會”或“不會”)出現溶液變紅的現象。
②取一段擦去表層氧化膜的鎂條,卷成螺旋狀,插入盛滿食鹽水的試管中,將試管倒扣在盛有食鹽水的燒杯中,可以迅速觀察到鎂持續不斷地跟水反應,你覺得可能的原因是___。
③去除了氧化膜的金屬Mg可以與NaHCO3溶液作用析出氫氣,溶液中有白色難溶物生成。這是由于鎂直接與水反應,轉化為H2和Mg(OH)2。溶解在水中的少量Mg(OH)2電離生成的OH-與溶液中的HCO3-反應生成CO32-,促使反應生成的Mg(OH)2更多溶解。溶液中Mg2+、OH-、CO32-,結合析出白色難溶物Mg2(OH)2CO3。請根據以上信息寫出Mg與NaHCO3溶液的總反應式:___(用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,室溫下分別向密閉容器內可移動活塞的兩邊充入空氣(已知空氣體積占整個容器容積的1/4)、H2 和O2 的混合氣體,若將H2、O2 的混合氣體點燃引爆。活塞先左彈,恢復室溫后,活塞右滑停留于容器的中央。則原來H2、O2 的物質的量之比可能為①4∶5 ② 2∶5 ③3∶8 ④7∶2
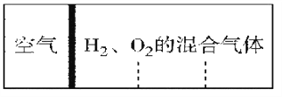
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應能用勒夏特列原理解釋的是
A. 加入催化劑有利于氨的合成
B. 煅燒粉碎的黃鐵礦礦石有利于SO2的生成
C. 硫酸生產中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
D. 工業制取金屬鉀Na(l)+KCl(l)![]() NaCl(l)+K(g)選取適宜的溫度,使K變成蒸氣從反應混合物中分離出
NaCl(l)+K(g)選取適宜的溫度,使K變成蒸氣從反應混合物中分離出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中,只含有下表中所示的四種離子,則X離子及其個數b可能為( )
離子 | Na+ | Al3+ | Cl- | X |
個數 | 3a | 3a | 2a | b |
A.![]() 、4aB.
、4aB.![]() 、4aC.
、4aC.![]() 、8aD.
、8aD.![]() 、5a
、5a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Ba(OH)2溶液中逐滴加入稀硫酸,請完成下列問題:
(1)寫出反應的離子方程式:________________________________________。
(2)下列三種情況下,離子方程式與 (1)相同的是_______(填序號)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液顯中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至過量
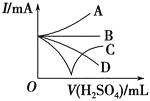
(3)若緩緩加入稀硫酸直至過量,整個過程中混合溶液的導電能力(用電流強度I表示)可近似地用如圖中的_______(填序號)曲線表示。
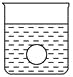
(4)若有一表面光滑的塑料小球懸浮于Ba(OH)2溶液中央,如圖所示。向該燒杯中緩緩注入與Ba(OH)2溶液等密度的稀硫酸至恰好完全反應。在此實驗過程中,小球將_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵(26Fe)、鈷(27Co)兩種元素均為第四周期元素,它們的用途極為廣泛。回答:
(1)26Fe位于元素周期表的第______縱行。
(2)為比較相同濃度的FeCl3溶液和CuSO4溶液對H2O2分解的催化效果,某研究小組進行了如下探究:
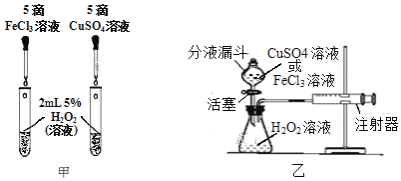
①如圖甲,可通過觀察______來定性比較兩者的催化效果。
②如圖乙,要定量比較兩者的催化效果,可測量生成等體積氣體所需的______。
③在FeCl3溶液中,究竟是哪種粒子起催化作用?
猜想1:鐵離子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要驗證猜想1成立,只需要在圖甲的兩只試管中分別加入同濃度、同體積的______和______,再通過觀察現象,即可證明猜想1成立。
(3)請仔細閱讀、分析下列有關利用鈷渣[含Co(OH)3、Fe(OH)3等]制備鈷氧化物的工藝流程圖,回答下列問題:
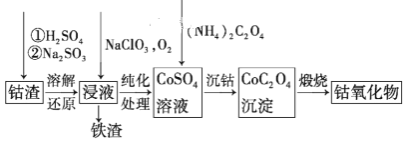
鐵渣中鐵元素的化合價為______,在空氣中煅燒CoC2O4(草酸鈷,其中碳為+3價),生成鈷氧化物和CO2,測得充分煅燒后固體質量為2.41g,CO2的體積為1.344L(標準狀況),則鈷氧化物的化學式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于在一個密閉容器中進行的反應C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列條件的改變對反應速率幾乎沒有影響的是
CO(g)+H2(g) ,下列條件的改變對反應速率幾乎沒有影響的是
①增加C的量; ②增加CO的量;
③將容器的體積縮小一半; ④保持體積不變,充入N2以增大壓強;
⑤升高反應體系的溫度; ⑥保持壓強不變,充入N2以增大體積。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com