
【題目】下列金屬分別和0..1mol /L的稀鹽酸反應,反應最劇烈的是
A. Fe B. Mg C. Al D. Cu
科目:高中化學 來源: 題型:
【題目】為了探究濃硫酸與蔗糖的炭化產物,設計下圖裝置進行實驗(a和b分別為兩個氣球)。

已知:CO氣體通入氯化鈀溶液,溶液變為黑色。
實驗過程如下:
I .按圖示連接好儀器,然后檢驗裝置的氣密性。
II.在雙通玻璃管中①②③④處分別放罝滴有酸性高錳酸鉀溶液的濾紙、滴有品紅溶液的濾紙、浸有氯化鈀溶液的濾紙和浸有溴水的濾紙。
III.夾好止水夾K,向三頸燒瓶A中的蔗糖上滴3~4滴蒸餾水,再加入3 mL濃硫酸,玻璃管中③處濾紙由白色變為黑色。
IV.打開止水夾K,使燒瓶內氣體緩慢通過B和C裝置,一段時間之后,發現④處的濾紙顏色沒有發生變化,C中的澄清石灰水變渾濁。
(1)裝置A中盛裝濃硫酸的儀器名稱為______;上述實驗體現了硫酸的那些性質_____。
(2)實驗步驟III中,向蔗糖上滴水的目的是_________________;
(3)若反應生成兩種碳的氧化物相同條件下的體積相同,寫出蔗糖炭化后發生反應的化學反應方程式_________。
(4)步驟IV的實驗目的是_______________________。
(5)該實驗體現了“微型實驗”綠色環保的優點,有人建議將裝置B改為滴有酸性高錳酸鉀溶液的濾紙置于后面的雙通玻璃管中,你對該改進建議的評價是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖的轉化關系判斷下列說法正確的是(反應條件已略去)( )
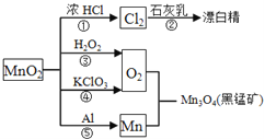
A. 反應①②③④⑤均屬于氧化反應和離子反應
B. 反應⑤說明該條件下鋁的還原性強于錳
C. 相同條件下生成等量的O2,反應③和④轉移的電子數之比為1︰1
D. 反應①中氧化劑與還原劑的物質的量之比為1︰4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,正確的是
A. 所有主族中都有非金屬元素 B. 同周期元素中,VIA族元素的原子半徑最大
C. 過渡元素都是金屬元素 D. VIA族元素的原子,其半徑越大,越容易得到電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
化合物H是一種有機光電材料中間體。實驗室由芳香化合物A制備H的一種合成路線如下: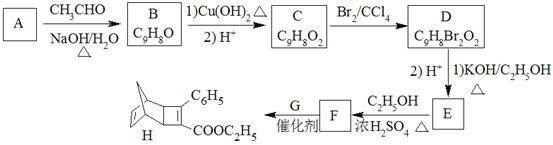
已知:
![]()
![]()
回答下列問題:
(1)A的化學名稱為為__________。
(2)由C生成D和E生成F的反應類型分別為__________、_________。
(3)E的結構簡式為____________。
(4)G為甲苯的同分異構體,由F生成H的化學方程式為___________。
(5)芳香化合物X是F的同分異構體,X能與飽和碳酸氫鈉溶液反應放出CO2,其核磁共振氫譜顯示有4種不同化學環境的氫,峰面積比為6∶2∶2∶1,寫出2種符合要求的X的結構簡式____________。
(6)寫出用環戊烷和2-丁炔為原料制備化合物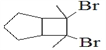 的合成路線________(其他試劑任選)。
的合成路線________(其他試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在t℃時,Ag2CrO4(橘紅色)在水中的沉淀溶解平衡平衡曲線如圖所示。又知t℃時AgCl的Ksp=4×10-10,下列說法不正確的是( )

A. 在t℃時,Ag2CrO4的Ksp為1×10-8
B. 在飽和溶液中加入K2CrO4可使溶液由Y點到Z點
C. 在t℃時,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常數K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常數K=6.25×107
D. 在t℃時,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由氮的化合物引起的環境污染稱為氮污染。
(1)己知CO將NO轉化為N2的方程式為2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH,某研究小組在實驗中研究溫度對NO轉化率的影響并繪制圖像。
N2(g)+2CO2(g) ΔH,某研究小組在實驗中研究溫度對NO轉化率的影響并繪制圖像。
①當n(NO)/n(CO)=l,容器容積恒定時,在不同溫度下反應相同的時間測得NO的轉化率變化如圖所示,則在此反應時間內應控制反應的最佳溫度在______左右,該反應的ΔH_____0 (填>或<)。

②該反應的平衡常數表達式為K=__________。
要同時提高平衡常數的值和NO的平衡轉化率,可采取的措施是________。
A.降低溫度 B.及時將CO2和N2從反應體系中移走
C.升高溫度 D.增大壓強
③在恒溫恒容容器中按體積比2∶1充入CO和NO的混合氣體,下列選項能說明正反應速率大于逆反應速率的是_____________(填序號)。
A.CO的濃度保持恒定 B.混合氣體的平均相對分子質量逐漸減小
C.CO和NO的物質的量之比逐漸增大 D.CO、NO、N2的速率之比為2∶2∶1
(2)在催化劑存在的條件下,用H2可以將NO還原為N2,己知:

則氫氣和一氧化氮反應生成氮氣和水蒸氣的熱化學方程式是_________________。
(3)MAP沉淀法是一種比較新穎有效的處理氨氮廢水的方法,.原理如下:向含NH4+的廢水中投加磷酸鹽和鎂鹽,使之和NH4+生成難溶復鹽MgNH4PO4·6H2O (簡稱MAP)。MAP沉淀法需要控制反應的PH在7.5-10之間,當PH過高時不利于生成MAP的原因是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關含高能量的正離子N5+的化合物N5AsF6的敘述正確的是( )
A.N5+與H2S是等電子體
B.N5AsF6化合物是共價分子
C.N5+中氮氮原子間以共用電子對結合
D.N5AsF6化合物是極性分子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com