
【題目】Ⅰ.煤制天然氣的工藝流程簡圖如下:
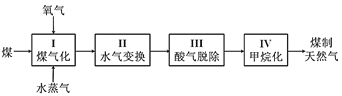
(1)反應Ⅰ:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧氣會與部分碳發生燃燒反應。請利用能量轉化及平衡移動原理說明通入氧氣的作用:___________________________。
CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧氣會與部分碳發生燃燒反應。請利用能量轉化及平衡移動原理說明通入氧氣的作用:___________________________。
(2)反應Ⅱ:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH=41 kJ·mol1。如圖表示不同溫度條件下,煤氣化反應Ⅰ發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系。
CO2(g) + H2(g) ΔH=41 kJ·mol1。如圖表示不同溫度條件下,煤氣化反應Ⅰ發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系。
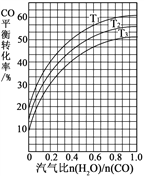
①判斷T1、T2和T3的大小關系:______________。(從小到大的順序)
②若煤氣化反應Ⅰ發生后的汽氣比為0.8,經煤氣化反應Ⅰ和水氣變換反應Ⅱ后,得到CO與H2的物質的量之比為1∶3,則反應Ⅱ應選擇的溫度是_______(填“T1”或“T2”或“T3”)。
(3)①甲烷化反應Ⅳ發生之前需要進行脫酸反應Ⅲ。煤經反應Ⅰ和Ⅱ后的氣體中含有兩種酸性氣體,分別是H2S和_______。
②工業上常用熱碳酸鉀溶液脫除H2S氣體得到兩種酸式鹽,該反應的離子方程式是__________。
Ⅱ.利用甲烷超干重整CO2技術可得到富含CO的氣體,將甲烷和二氧化碳轉化為可利用的化學品,在能源和環境上的意義重大。該技術中的化學反應為:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0
2H2O(g)+4CO(g) ΔH>0
CH4超干重整CO2的催化轉化原理示意如圖:
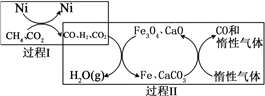
(4)過程Ⅱ,實現了含氫物種與含碳物種的分離。生成H2O(g)的化學方程式是______________。
(5)假設過程Ⅰ和過程Ⅱ中的各步均轉化完全,下列說法正確的是_______。((填序號)
a.過程Ⅰ和過程Ⅱ中均含有氧化還原反應
b.過程Ⅱ中使用的催化劑為Fe3O4和CaCO3
c.若過程Ⅰ投料![]() =1,可導致過程Ⅱ中催化劑失效
=1,可導致過程Ⅱ中催化劑失效
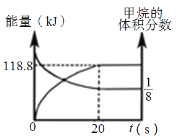
(6)一定條件下,向體積為2 L的恒容密閉容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),發生反應CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0,實驗測得,反應吸收的能量和甲烷的體積分數隨時間變化的曲線圖像如圖。計算該條件下,此反應的ΔH=________________。
2H2O(g)+4CO(g) ΔH>0,實驗測得,反應吸收的能量和甲烷的體積分數隨時間變化的曲線圖像如圖。計算該條件下,此反應的ΔH=________________。
【答案】(1)氧氣與碳發生燃燒反應放熱,放出的熱被可逆反應吸收利用,促進反應正向移動
(2)①T1 <T2<T3 ②T3
(3)①CO2 ②![]() +H2S
+H2S![]() HS +
HS +![]()
(4)4H2+Fe3O4![]() 3Fe+4H2O
3Fe+4H2O
(5)ac
(6)+330 kJ·mol1
【解析】Ⅰ、(1)C(s)+H2O(g)![]() CO(g)+H2(g) △H=+135 kJ·mol1,是吸熱反應,而碳與氧氣反應放出熱量,使反應C(s)+H2O(g)
CO(g)+H2(g) △H=+135 kJ·mol1,是吸熱反應,而碳與氧氣反應放出熱量,使反應C(s)+H2O(g)![]() CO(g)+H2(g),向正反應方向移動,提高碳的利用率;
CO(g)+H2(g),向正反應方向移動,提高碳的利用率;
(2)①反應CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=41 kJ·mol1的正反應為放熱反應,溫度越高,一氧化碳的轉化率越低,由圖可知,溫度的大小為:T1<T2<T3;
CO2(g)+H2(g) △H=41 kJ·mol1的正反應為放熱反應,溫度越高,一氧化碳的轉化率越低,由圖可知,溫度的大小為:T1<T2<T3;
②若煤氣化反應Ⅰ發生后的汽氣比為0.8,設水蒸氣的物質的量是4 mol、則生成的CO物質的量為5 mol,同時生成5 mol氫氣,經煤氣化反應Ⅰ和水氣變換反應Ⅱ后,設反應Ⅱ中CO轉化的為x mol,則生成x mol氫氣,則(5x)∶(5+x)=1∶3,x=2.5,CO的轉化率=![]() ×100%=50%,根據圖知,反應溫度為T3;
×100%=50%,根據圖知,反應溫度為T3;
(3)①根據方程式Ⅱ知,生成的酸性氣體還有二氧化碳;②工業上常用熱碳酸鉀法脫除H2S氣體得到兩種酸式鹽,則二者反應生成碳酸氫鉀和硫氫化鉀,反應方程式為K2CO3+H2SKHS+KHCO3;
Ⅱ、(4)由圖示可知,過程Ⅱ中氫氣還原Fe3O4生成H2O,發生反應的化學方程式是4H2+Fe3O4![]() 3Fe+4H2O;
3Fe+4H2O;
(5)假設過程Ⅰ和過程Ⅱ中的各步均轉化完全,a.過程Ⅰ有氫氣生成,而過程Ⅱ中存在氫氣還原四氧化三鐵和CO還原四氧化三鐵,均屬于氧化還原反應,故a正確;b.過程Ⅱ中使用的催化劑為Fe3O4和CaO,故b錯誤;c.若過程Ⅰ投料![]() =1,則CH4和CO2恰好生成CO和H2,無多余的CO2,導致過程Ⅱ中只能生成FeO,催化劑效果降低,故c正確;答案為ac;
=1,則CH4和CO2恰好生成CO和H2,無多余的CO2,導致過程Ⅱ中只能生成FeO,催化劑效果降低,故c正確;答案為ac;
(6) CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g)
起始物質的量(mol) 1.2 4.8 0 0
變化物質的量(mol) x 3x 2x 4x
平衡物質的量(mol) 1.2 x 4.83x 2x 4x
平衡時CH4的體積為![]() =
=![]() ,解得x=0.36 mol,則ΔH=+118.8×
,解得x=0.36 mol,則ΔH=+118.8×![]() kJ·mol1=+330 kJ·mol1。
kJ·mol1=+330 kJ·mol1。


科目:高中化學 來源: 題型:
【題目】大力發展電動汽車,可以有效控制空氣污染。目前機動車常使用的電池有鉛蓄電池、鋰電池等。
I.鉛蓄電池充放電的總反應為:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O,鋰硫電池充放電的總反應為:2Li+S
2PbSO4+2H2O,鋰硫電池充放電的總反應為:2Li+S![]() Li2S。
Li2S。
(1)82Pb的原子結構示意圖為 。鉛蓄電池的正極材料為_________。
(2)當消耗等質量的負極活性物質時,鋰硫電池的理論放電量是鉛蓄電池的 ____倍。(保留三位有效數字)。
(3)古代用PbSO4作油畫的白色顏料,置于空氣會慢慢變成黑色的PbS,從而使油畫色彩變暗。用H2O2清洗可使油畫“復原”。用化學方程式表示該復原的原理________。
II.由方鉛礦(PbS)制備鉛蓄電池電極材料(PbO2)的方法如下:
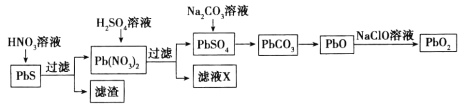
(4)濾液X是一種可循環使用的物質,其溶質主要是__________________(填化學式),若X中殘留的![]() 過多,循環使用時可能出現的問題是___________________________。
過多,循環使用時可能出現的問題是___________________________。
(5)向 PbSO4中加Na2CO3溶液會發生:PbSO4 (s)+ ![]() (aq)
(aq)![]() PbCO3 (s)+
PbCO3 (s)+ ![]() (aq)。已知25℃時,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并計算該反應此溫度下的平衡常數K 。(提示:需寫出K的表達式、代入數據、算出結果)
(aq)。已知25℃時,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并計算該反應此溫度下的平衡常數K 。(提示:需寫出K的表達式、代入數據、算出結果)
(6)以石墨為電極電解Pb(NO3)2溶液也可以制得PbO2。PbO2將在 極生成(填“陰”或“陽”);而另一極的電極反應式為 ,故Pb元素的利用率較低。若在Pb(NO3)2溶液中加入適量Cu(NO3)2則可有效利用Pb2+,其理由是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香豆素-4是一種激光染料,應用于可調諧染料激光器。香豆素-4由C、H、O三種元素組成,分子球棍模型如圖所示。下列有關敘述正確的是

①分子式為![]()
②能與飽和溴水發生取代反應
③能與飽和溴水發生加成反應
④能使酸性![]() 溶液褪色
溶液褪色
⑤1mol香豆素-4最多能與含1molNaOH的溶液反應
A. ①②③ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵、銅及其化合物在日常生產、生活中有著廣泛的應用。回答下列問題:
(1)鐵元素在周期表中的位置是_______,基態Cu2+的核外電子排布式是__________。元素鐵與銅的第二電離能分別為:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有機鐵肥三硝酸六尿素合鐵(Ⅲ),化學式為:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的雜化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”與 Fe(Ⅲ)之間的作用力是_______。根據價層電子對互斥理論推測 NO3-的空間構型為____________。
(3)Fe3+可用SCN-檢驗,其對應的酸有兩種,分別為硫氰酸(H-S-C≡N)和異硫氰酸(H-N=C=S),這兩種酸中沸點較高的是_______, 原因是______________。
(4)FeCl3晶體易溶于水和乙醇,用酒精燈加熱即可氣化,由此可知 FeCl3的晶體類型為______;S和Fe形成的某化合物,其晶胞如圖一所示, 則該物質的化學式為__________。

(5)Cu晶體的堆積方式如圖二所示,晶體中Cu原子的配位數為_______;設Cu原子半徑為a,晶體空間利用率為 _________(用含a 的式子表達,不化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C三種物質隨著X的變化,Y發生相應的變化,其變化關系如圖所示。

(1)若X表示的是物質的量,則Y表示的不可能是_____(填序號,下同)
①物質的量 ②物質的體積 ③物質所含分子或原子的數目 ④物質的摩爾質量
(2)若A、B、C均為氣體且壓強恒定時,X表示的是溫度,則Y表示的可能是______。
①氣體的質量 ②氣體的分子數 ③氣體的體積 ④氣體的摩爾質量
(3)若A、B、C均為氣體,Y表示在相同條件下氣體的體積,X表示的是氣體的質量。
①相同條件下A、B、C三種氣體的密度由大到小的順序是_____(用字母A、B、C表示,下同)。
②A、B、C三種氣體的摩爾質量由大到小的順序是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 1mol N2 的質量是14g B. H2SO4的摩爾質量是98 g/mol
C. H2O的摩爾質量是18 D. 1mol HCl的質量是36.5 g /mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
氯吡格雷是一種血小板聚集抑制劑,該藥物以![]() 為原料的合成路線如圖:
為原料的合成路線如圖:
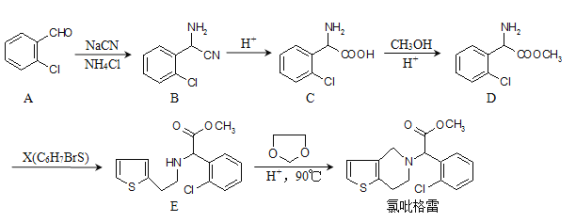
請根據以上信息,結合自己掌握的知識和具有的經驗回答下列問題:
(1)分子C中無氧官能團的名稱為____________。 命名為__________。
命名為__________。
(2)D→E的反應類型是_________反應。
(3)X的結構簡式為___________________。
(4)下列敘述正確的是________(填序號)。
A.A物質中所有原子均可共面 B.C物質可發生取代、氧化、還原反應
C.![]() 在水中溶解度小 D.E中有兩個手性碳原子
在水中溶解度小 D.E中有兩個手性碳原子
(5)分子C在一定條件下生成一種含有3個六元環的產物的化學方程式為_____________。
(6)同時滿足下列兩個條件的B的同分異構體共有_____種(不包括B)。
①與B含有相同的官能團;②苯環上的取代基不超過2個。
(7)已知:![]() ,則由乙醇、甲醇為有機原料制備化合物
,則由乙醇、甲醇為有機原料制備化合物![]() 需要經歷的反應類型有______(填序號)。
需要經歷的反應類型有______(填序號)。
①加成反應 ②消去反應 ③取代反應 ④氧化反應 ⑤還原反應
寫出制備化合物![]() 的最后一步反應:______________________。
的最后一步反應:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于堿金屬單質的描述正確的是( )
A. 堿金屬都可以保存在煤油中
B. 堿金屬與水反應,均浮在水面上
C. 在空氣中加熱均可生成多種氧化物
D. 硬度小、密度小、熔點低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1-溴丙烷是一種重要的有機合成中間體,沸點為71℃,密度為1.36g.cm-3。實驗室制備少量1-溴丙烷的主要步驟如下:
步驟1:在儀器A中加入攪拌磁子、12g正丙醇及20mL水,冰水冷卻下緩慢加入28mL濃H2SO4;冷卻至室溫,攪拌下加入24gNaBr。
步驟2:如上圖所示搭建實驗裝置,緩慢加熱,直到無油狀物餾出為止。
步驟3:將餾出液轉入分液漏斗,分出有機相。
步驟4:將分出的有機相轉入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗滌,分液,得粗產品,進一步提純得1-溴丙烷。

(1)儀器A、B的名稱分別是____________________ 、______________________。
(2)反應時生成的主要有機副產物有_______________。(寫出兩種物質的結構簡式)
(3)步驟2中需向接受瓶內加入少量冰水并置于冰水浴中的目的是_____________。
(4)寫出生成1-溴丙烷的化學方程式_______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com