
【題目】某廠廢水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性較大。某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合價依次為+3、+2),設計了如下實驗流程:

(1)第①步反應的離子方程式是__________________________________________。
(2)第②步中用pH試紙測定溶液pH的操作是________________________________。
(3)第②步過濾得到的濾渣中主要成分除Cr(OH)3外,還有_____________________。
(4)欲使1 L該廢水中的Cr2O72-完全轉化為Cr0.5Fe1.5FeO4,理論上需要加入________g FeSO4·7H2O。
(5)FeSO4·7H2O晶體制備步驟如下:取過量潔凈的鐵屑,加入20%~30%的稀硫酸溶液,在50 ℃~80℃水浴中加熱至不再產生氣泡。將溶液趁熱過濾,濾液移至試管中,用橡膠塞塞緊試管口,靜置、冷卻一段時間后收集產品。
①反應時鐵屑過量的目的是(用離子方程式表示) ________________________。
②溶液趁熱過濾的原因是___________________________________________。
【答案】Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 將一小塊pH試紙放在表面皿上,用玻璃棒蘸取少量待測液,點在pH試紙上,再與標準比色卡對照 Fe(OH)3、Fe(OH)2 13.9 Fe+2Fe3+=3Fe2+ 減少FeSO4的損失;防止空氣進入試管將Fe2+氧化為Fe3+
【解析】
廢水中的Cr2O72-具有氧化性,在酸性條件下,與FeSO4·7H2O發生氧化還原反應生成含有Fe3+和Cr3+溶液,根據得到磁性材料Fe的化合價依次為+3、+2,因此加入的FeSO4·7H2O需要過量,形成含有Fe2+ 、Fe3+ 、Cr3+、SO42-的溶液,通過加入NaOH調節溶液的pH值用pH試紙測定溶液pH為9,在堿性條件下使Fe2+ 、Fe3+ 、Cr3+完全轉化為Cr(OH)3、Fe(OH)3和Fe(OH)2三種沉淀,通過過濾操作與SO42-分離,最后對Cr(OH)3、Fe(OH)3和Fe(OH)2三種沉淀洗滌、干燥、焙燒,最終制得磁性材料Cr0.5Fe1.5FeO4。
(1)Cr2O72有較強氧化性,FeSO4·7H2O中Fe2+有一定的還原性,在酸性介質中發生氧化還原反應,由實驗流程可知,第①步反應中Cr2O72在酸性條件下將Fe2+氧化為Fe3+,自身被還原為Cr3+,根據得失電子、原子守恒及所處環境可知,還應有水生成,反應離子方程式為Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)用pH試紙測定溶液pH的操作是將一小塊pH試紙放在表面皿上,用玻璃棒蘸取少量待測液,點在pH試紙上,再與標準比色卡對照;
(3)由題給框圖之二可得:Fe2+過量,加NaOH時,產生Cr(OH)3、Fe(OH)3和Fe(OH)2三種沉淀物,故答案為:Fe(OH)3、Fe(OH)2;
(4)1L廢水中含n(Cr2O72-)=5.00×103mol,根據Cr原子、Fe原子守恒,可得:Cr2O72-4Cr0.5Fe1.5FeO410FeSO4·7H2O,所以理論上n(FeSO47H2O)=10n(Cr2O72-)=5.00×103mol×10=0.05mol,所以m(FeSO47H2O)=0.05mol×278g/mol=13.9g;
(5)①鐵粉過量是防止亞鐵離子被氧化,鐵和鐵離子反應重新生成亞鐵離子,反應的離子方程式為:Fe+2Fe3+=3Fe2+;
②一般物質的溶解度隨溫度的升高而增大,因此熱溶液趁熱過濾可減少硫酸亞鐵晶體析出,從而減小FeSO4的損失。


科目:高中化學 來源: 題型:
【題目】下列顏色變化與氧化還原反應無關的是( )
A. FeCl3溶液滴入Mg(OH)2濁液,白色濁液轉化為紅褐色沉淀
B. AgNO3溶液滴入氯水中,產生白色沉淀,隨后淡黃色褪去
C. Na放在坩堝里并加熱,發生黃色火焰,生成淡黃色固體
D. H2C2O4溶液滴入KMnO4酸性溶液中,產生氣泡,隨后紫色褪去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁廣泛應用于電子陶瓷等工業領域。在一定條件下,AlN可通過反應:Al2O3+N2+3C![]() 2AlN+3CO合成。下列敘述正確的是
2AlN+3CO合成。下列敘述正確的是
A. AlN中氮的化合價為+3B. 上述反應中,每生成1 mol AlN需轉移3 mol電子
C. AlN的摩爾質量為41 gD. 上述反應中,N2是還原劑,Al2O3是氧化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2O2是重要的化工原料,具有多種用途。
(1)寫出CO2和Na2O2反應的化學方程式:___________________________________。
(2)某學生判斷SO2和Na2O2反應能生成硫酸鈉,你認為他的判斷合理嗎?__________,簡要說明理由:_______________________________________________。
(3)該同學無法斷定反應中是否有氧氣生成,擬使用如圖所示裝置進行實驗(圖中鐵架臺等裝置已略去)。
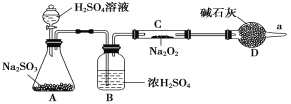
裝置中B的作用是_________________,D的作用是_____________________。
(4)將足量的Na2O2投入到含有下列離子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,設反應完畢后,無固體析出,則上述離子數目減少的有__________,數目增多的離子有________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,10 mL 0.40 mol/L H2O2溶液發生催化分解。不同時刻測得生成O2的體積(已折算為標準狀況)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列敘述不正確的是(溶液體積變化忽略不計)( )
A. 0~6 min的平均反應速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反應速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反應至6 min時,c(H2O2)=0.3 mol/L
D. 反應至6 min時,H2O2分解了50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各溶液中,Na+物質的量濃度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在150℃時碳酸銨可以受熱完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,則其完全分解后所產生的氣態混合物的密度是相同條件下氫氣密度的幾倍
2NH3↑ + H2O↑ + CO2↑,則其完全分解后所產生的氣態混合物的密度是相同條件下氫氣密度的幾倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(一)現有四種有機物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥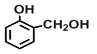 ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一個國家的石油化工生產水平的是__________(填序號),該物質可用于制備常用塑料,其反應化學方程式是_______________________。
(2)能用來制取梯恩梯(TNT)的是________(填序號),其發生反應的化學方程式是__________________;
(3)上述有機物能與金屬鈉發生反應的是_________(填序號),與⑧互為同分異構體的是___________(填序號),⑤與酸性高錳酸鉀反應的產物是______________(填結構簡式);
(二)實驗室用燃燒法測定某固體有機物A的分子組成,測定裝置如圖所示(鐵架臺、鐵夾、酒精燈等未畫出):
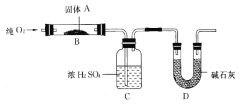
取17.1g A放入B裝置中,持續通入過量O2燃燒,生成CO2和H2O,請回答下列有關問題:
(4)D裝置的作用是____________________,有同學認為該套裝置有明顯的缺陷,需要改進,該同學判斷的理由是___________________;
(5)裝置改進后進行實驗,若A的摩爾質量為342g/mol,C裝置增重9.9g,D裝置增重26.4 g,則A的分子式為_____________________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com