
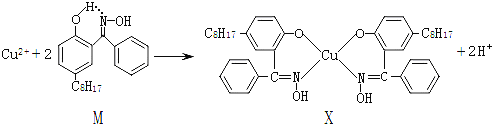
【題目】利用銅萃取劑M,通過如下反應實現銅離子的富集:
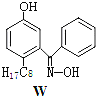
(1)關于M所含元素的說法正確的是______________。
A.電負性由大到小順序:O>N>C>H
B.第一電離能由大到小的順序:O>N>C
C.氮原子以sp2雜化軌道與氧原子形成σ鍵
D.從物質分類角度M屬于芳香烴,M中所有的碳原子不可能共面
E.組成M元素的氫化物穩定性:CH4<H2O<NH3
(2)上述反應中斷裂和生成的化學鍵有_______(填序號)。
A.氫鍵 B.配位鍵 C.金屬鍵 D.范德華力 E.共價鍵 F.離子鍵
(3)M與W(分子結構如上圖)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基態Cu2+的外圍電子排布圖為________________,Cu2+等過渡元素水合離子是否有顏色與原子結構有關,且存在一定的規律。判斷Sc3+、Zn2+的水合離子為無色的依據是_____________________________________________________________。
離子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
顏色 | 無色 | 紫紅色 | 淺綠色 | 藍色 | 無色 |
(5)已知:Y原子最高價氧化物對應水化物的酸性最強。銅與Y形成化合物的晶胞如附圖所示(黑點代表銅原子,空心圓代表Y原子)。
①該晶體的化學式為_______________。(用元素符號表示)
②已知銅和Y原子的電負性分別為1.9和3.0,則銅與Y原子形成的化合物屬于____________(填“離子”或“共價”)化合物。
③已知該晶體的密度為ρg·cm-3,阿伏加德羅常數為NA,則該晶體中銅原子與Y原子之間的最短距離為_______________pm(只寫計算式)。
【答案】ACBEM能形成分子內氫鍵,使溶解度減小![]() 3d軌道上沒有未成對電子(3d軌道上電子為全空或全滿)CuCl共價
3d軌道上沒有未成對電子(3d軌道上電子為全空或全滿)CuCl共價![]() ×
×![]() ×1010或
×1010或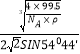 ×1010或
×1010或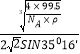 ×1010
×1010
【解析】
(1)M所含元素為C、H、O、N;
A.元素的非金屬性越強,電負性越強;即同周期自左而右電負性增大;同一主族元素從上到下電負性逐漸減小;
B.同周期元素從左到右元素的第一電離能逐漸減小,則C元素的最小,由于N的2p軌道電子為半充滿狀態,難以失去電子,第一電離能大于O;
C.由結構簡式可知N原子共形成3對共價鍵,1個配位鍵,即N原子采取sp2雜化;
D.芳香烴是含有苯環的烴,只含碳氫兩種元素;
E.元素的非金屬性越強,氫化物越穩定,以此解答。
(2)酚羥基中O-H間斷裂,銅離子與O原子、N原子之間形成配位鍵,據此解答即可;
(3)分子內氫鍵的存在,導致水溶性減小,據此解答即可;
(4)根據核外電子排布規律書寫Cu原子的核外電子排布式,電子按能層高低進行失去,進而書寫Cu2+的外圍電子排布圖;判斷Sc3+、Zn2+離子的原子核外3d軌道上是否含有電子來判斷是否有顏色;
(5)①Y原子最高價氧化物對應水化物的酸性最強,可知Y是氯元素(Cl),該晶胞中銅原子個數=4,Cl原子個數=8× 1/8 +6× 1/2=4;
②電負性差大于1.7的鍵一般是離子鍵,小于1.7的一般為共價鍵,據此判斷;
③Cu原子與周圍的4個Cl原子形成正四面體結構,正四面體體心的Cu與晶胞頂點Cl原子距離最短,它們的連線處于晶胞體對角線上,且為晶胞體對角線長度的 1/4 ,根據晶胞含有原子數目計算晶胞質量,結合密度計算晶胞體積,進而計算晶胞棱長,晶胞體對角線長度為棱長的 ![]() 倍。
倍。
(1)A.元素的非金屬性越強,電負性越強;即同周期自左而右電負性增大;同一主族元素從上到下電負性逐漸減小,故電負性由大到小順序:O>N>C>H,A正確;
B.同周期元素從左到右元素的第一電離能逐漸減小,則C元素的最小,由于N的2p軌道電子為半充滿狀態,難以失去電子,第一電離能大于O,所以第一電離能從大到小的順序為:N>O>C,B錯誤;
C.由結構簡式可知N原子共形成3對共價鍵,1個配位鍵,即N原子采取sp2雜化,故C正確;
D.芳香烴是含有苯環的烴,故M不屬于芳香烴,D錯誤;
E.元素的非金屬性越強,氫化物越穩定,則組成M元素的氫化物穩定性:CH4<NH3<H2O,故E錯誤;
因此,本題答案為:AC;
(2)M中酚羥基中O-H間斷裂,銅離子與O原子、N原子之間形成配位鍵,
因此,本題答案為:BE;
(3)由于M能形成分子內氫鍵,使溶解度減小,
因此,本題答案為:M能形成分子內氫鍵,使溶解度減小;
(4)Cu原子的核外電子排布式為1s22s22p63s23p63d104s1,故基態Cu2+的外圍電子排布圖為![]() ,Zn2+離子的原子核外排布式為1s22s22p63s23p63d10,d軌道上有10個電子,故Zn2+無色,Sc3+離子的原子核外排布式為1s22s22p63s23p6,其d軌道上有0電子,處于全空,故沒有顏色,
,Zn2+離子的原子核外排布式為1s22s22p63s23p63d10,d軌道上有10個電子,故Zn2+無色,Sc3+離子的原子核外排布式為1s22s22p63s23p6,其d軌道上有0電子,處于全空,故沒有顏色,
因此,本題答案為:![]() ;3d軌道上沒有未成對電子(3d軌道上電子為全空或全滿);
;3d軌道上沒有未成對電子(3d軌道上電子為全空或全滿);
(5)Y原子最高價氧化物對應水化物的酸性最強,可知Y是氯元素(Cl)。
①該晶胞中銅原子個數=4,Cl原子個數=8× 1/8 +6× 1/2 =4,所以其化學式為CuCl;
②銅和的電負性相差3.01.9=1.1,電負性差大于1.7的鍵一般是離子鍵,小于1.7的一般為共價鍵,故Cu與Y形成的化合物屬于共價化合物,故答案為:共價;
③四面體的中心原子與兩個頂點形成的夾角為109°28′,設銅原子與Y原子之間的距離(即中心原子與頂點的距離)為x,立方體邊長a,則四面體的邊長為 ![]() a,則由余弦定理可得:(
a,則由余弦定理可得:(![]() a)2=x2+x2-2x2cos109°28′,x=
a)2=x2+x2-2x2cos109°28′,x=![]() ,由于cos2α=1-2sin2α,
,由于cos2α=1-2sin2α,
所以cos109°28′=1-sin254°44′,1-cos109°28′=sin254°44′,x=![]() ,
,
晶體體積為 zM/NAρ,z表示一個晶胞中含有的CuCl的數目,已知z=4,
a=![]() ×1010,x=
×1010,x=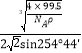 ×1010。
×1010。
由于sin54°44′=cos35°16′,x=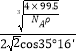 ×1010。
×1010。
四面體頂點到中心的距離與四面體邊長的關系為x= ![]() a=
a=![]() a,故x=
a,故x=![]() ×
×![]() ×1010pm。
×1010pm。
因此,本題答案為:![]() ×
×![]() ×1010或
×1010或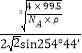 ×1010或
×1010或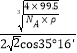 ×1010。
×1010。


科目:高中化學 來源: 題型:
【題目】下列說法正確的是(用NA表示阿伏加德羅常數的值)
A. 17g羥基(-OH)所含有的電子數是10 NA個
B. 常溫下,14g乙烯含有的共用電子對數是2.5NA個
C. 12 g石墨中含有C﹣C鍵的個數為1.5NA
D. 標準狀況下,CH4發生取代反應生成22.4LCH2Cl2,需要消耗2NA個Cl2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機物的說法不正確的是
A. 苯乙烯所有原子可處于同一平面
B. 由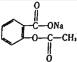 轉變為
轉變為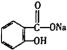 :可與足量NaOH溶液共熱后,再通入足量二氧化碳
:可與足量NaOH溶液共熱后,再通入足量二氧化碳
C. 蔗糖分子可以看作是兩個不同的單糖分子間脫去一個水分子形成的
D. 1mol油脂在酸性條件下充分水解,可制得3mol高級脂肪酸和1mol甘油
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物結構的說法錯誤的是( )
A.一氯乙烷有兩種同分異構體B.苯分子中六個碳碳鍵鍵長完全相等
C.乙烯分子中所有原子處于同一平面內D.乙醇的核磁共振譜圖中有3個特征峰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據有關信息解答下列化學實驗問題:
(Ⅰ)醛類是重要的工業原料,可以跟亞硫酸氫鈉飽和溶液反應,生成物是α﹣羥基磺酸鈉(易溶于水,不溶于飽和亞硫酸氫鈉溶液)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na
R-CH(OH)-SO3Na
(1)上述反應類型為________反應。若使CH3 CH(OH)-SO3Na全部變成乙醛,可采用的試劑是__________或__________;分離乙醛的操作方法 _____________。
(Ⅱ)實驗室利用苯甲醛(安息香醛)制備苯甲醇和苯甲酸的化學原理:
![]() (此原理適用于無α-氫的醛)
(此原理適用于無α-氫的醛)
已知部分物質的性質:
苯甲醇:熔點(℃):-15.3℃,稍溶于水,易溶于有機溶劑;
苯甲醛:熔點(℃):-26℃,微溶于水,易溶于有機溶劑;
苯甲酸:溶解度為0.344g(25℃),易溶于有機溶劑.主要過程如圖所示:
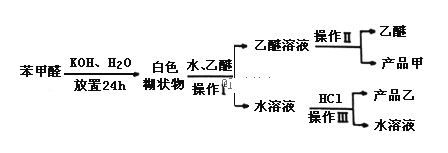
回答下列問題:
(2)操作Ⅰ的名稱是___________,乙醚溶液中所溶解的主要成分是__________;
(3)操作Ⅲ的名稱是________,產品乙是_______________.
(4)按上述操作所得的產品甲中常含有一定量的有機雜質___________(填寫雜質的名稱);限用下列試劑:酸性KMnO4、稀NaOH溶液、稀H2SO4、飽和NaHSO3溶液.寫出檢驗產品甲中含有該雜質的過程:______________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2011年12月江西銅業排污禍及下游,據測定廢水中重金屬污染物和有毒非金屬污染物達二十余種,當地民眾重金屬中毒病癥和奇異怪病時有發生. 廢水中的重金屬指的是( )
A. 金屬單質 B. 金屬元素 C. 金屬銅 D. 金屬氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質。以下是制備精鹽的實驗方案,各步操作流程如下:
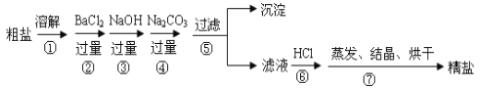
(1)在第①步粗鹽溶解操作中要用玻璃棒攪拌,作用是___________________________。
(2)第②步操作的目的是除去粗鹽中的__________(填化學式),判斷BaCl2已過量的方法是____________________________________________________________。
(3)在第③步操作中,選擇的除雜的試劑不能用KOH代替NaOH,理由是________________。
(4)第⑤步“過濾”操作中得到沉淀的成分有:泥沙、BaSO4、________、__________。
(5)“蒸發結晶”用到的器材有:鐵架臺(鐵圈)、坩堝鉗、酒精燈、火柴、玻璃棒、______。
(6)第④步除原食鹽中雜質離子與碳酸根的反應外還有的反應的離子方程式為:______________________________;
(7)第⑥步操作中涉及反應的離子方程式有:__________________、__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉與水反應的離子方程式正確的是( )
A. 2Na+3H+=2Na++H2↑
B. Na+H2O=Na++OH-+H2↑
C. 2Na+2H2O=2Na++2OH-+H2↑
D. 2Na+2H2O=2Na++O2↑+2H2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com