
【題目】下列烷烴的命名正確的是( )
A.2,4﹣二乙基戊烷
B.4﹣甲基﹣3﹣乙基已烷
C.2﹣甲基﹣3﹣丙基戊烷
D.2,3,3﹣三甲基戊烷
 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:
【題目】4種相鄰主族短周期元素的相對位置如表,元素x的原子核外電子數是m的2倍,y的氧化物具有兩性,回答下列問題: 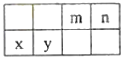
(1)元素x在周期表中的位置是第周期,第族,其單質可采用電解熔融的方法制備.
(2)m、n、y三種元素最高價氧化物的水化物中,酸性最強的是 , 堿性最強的是 . (填化學式)
(3)氣體分子(mn)2的電子式為 . (mn)2成為擬鹵素,性質與鹵素類似,其與氫氧化鈉溶液反應的化學方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅是一種應用廣泛的金屬,目前工業上主要采用“濕法”工藝冶煉鋅.某含鋅礦的主要成分是ZnS(還含有少量FeS等其它成分),以其為原料煉鋅的工藝流程如圖所示: 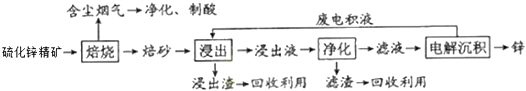
回答下列問題:
(1)硫化鋅精礦的焙燒在氧氣氣氛的沸騰爐中進行,所產生焙砂的主要成分的化學式為 .
(2)焙燒過程中產生的含塵煙氣可凈化制酸,該酸可用于后續的操作.
(3)浸出液“凈化”過程中加入的主要物質為 , 其作用是 .
(4)電解沉積過程中的陰極采用鋁板,陽極采用Pb﹣Ag合金惰性電極,陽極逸出的氣體是 .
(5)改進的鋅冶煉工藝,采用了“氧壓酸浸”的全濕法流程,既省略了易導致空氣污染的焙燒過程,又可獲得一種由工業價值的非金屬單質,“氧壓酸浸”中發生主要反應的離子方程式為 .
(6)我國古代曾采用“火法”工藝冶煉鋅.明代宋應星著《天工開物》中有關“升煉倭鉛”的記載:“爐甘石十斤,裝載入一尼罐內,…,然后逐層用煤炭餅墊盛,其底鋪薪,發火鍛紅,…,冷淀,毀罐取出,…即倭鉛也.”該煉鋅工藝主要反應的化學方程式為 . (注:爐甘石的主要成分為碳酸鋅,倭鉛是指金屬鋅).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量Fe和Fe2O3的混合物放入300mL 2mol/L的硝酸溶液中,反應完全后無固體剩余,生成4.48L NO氣體(標準狀況),再向反應后的溶液中加入1mol/L的NaOH溶液,要使鐵元素全部沉淀下來,所加NaOH溶液的體積最少是( )
A.400mL
B.500mL
C.450mL
D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鎂是科學家們制備的一種重要化合物,它可由單只直接化合而成,它與水作用的產物之一為NH3 . 請回答下列問題:
(1)Na3N是由鍵形成的化合物,寫出它的電子式: .
(2)Na3N與水反應屬于(填基本反應類型),寫出該反應的化學方程式: .
(3)Na+與N3﹣的半徑關系是Na+(填“>”、“<”或“=”)N3﹣ .
(4)Mg3N2與鹽酸的反應生成種鹽,用電子式表示其中只含有離子鍵的鹽的形成過程 , 寫出另一種鹽的電子式
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某燒堿樣品中含有少量不與酸作用的可溶性雜質,為了測定其純度,進行滴定操作:
操作步驟:
A.在250mL容量瓶中配制250mL燒堿溶液
B.用堿式滴定管量取25.00mL燒堿溶液于錐形瓶中并加幾滴甲基橙指示劑
C.在天平上準確稱取燒堿樣品w g,在燒杯中加蒸餾水溶解
D.將物質的量濃度為m mol/L的標準H2SO4溶液裝入酸式滴定管,調整液面,記下開始刻度V1 mL
E.在錐形瓶下墊一張白紙,滴定到終點,記錄終點刻度為V2 mL
附:酸堿指示劑變色范圍
指示劑 | 變色范圍 | 酸色 | 堿色 |
石蕊 | 5.0﹣8.0 | 紅色 | 藍色 |
酚酞 | 8.0﹣10.0 | 無色 | 紅色 |
甲基橙 | 3.1﹣4.4 | 紅色 | 黃色 |
請完成下列問題:
(1)選用儀器如下:①量筒;②錐形瓶;③滴定管;④玻璃棒.上列儀器中在使用前需檢查是否漏水的是 . (填序號)除以上儀器外還缺的玻璃儀器有、 .
(2)正確的操作步驟是(填寫字母)→→→→ .
(3)滴定管讀數應注意 .
(4)操作中錐形瓶下墊一張白紙的作用是 .
(5)操作D中液面應調整到;
(6)滴定到終點時錐形瓶內溶液的pH約為;終點時的顏色變化是 .
(7)若酸式滴定管沒用標準H2SO4潤洗,會對測定結果有何影響(填“偏高”、“偏低”或“無影響”,其他操作均正確).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據所學知識,完成題目:
(1)在標準狀況下1.7g氨氣所占的體積為 , 它與同條件下molH2S含有相同的氫原子.
(2)某氣體物質質量為6.4g,含有6.02×1022個分子,則該氣體的摩爾質量為 .
(3)100mL、0.5mol/L的(NH4)2SO4溶液中含有NH ![]() mol,這些NH
mol,這些NH ![]() 中所含有的電子的物質的量為 , 質子的物質的量為 .
中所含有的電子的物質的量為 , 質子的物質的量為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室通常用MnO2和濃鹽酸共熱制取Cl2 , 反應的化學方程式為MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O.
MnCl2+Cl2↑+2H2O.
(1)該反應的氧化劑是 , 氧化產物是 , 用雙線橋法表示上述反應電子轉移方向和數目.
(2)計算當有73.0克HCl完全參加反時,消耗MnO2的物質的量為多少?生成的氣體在標準狀況下的體積多少升?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國最新戰機殲﹣31使用了高強度、耐高溫的鈦合金材料.工業上冶煉鈦的反應如下:
TiCl4+2Mg ![]() Ti+2MgCl2 . 下列有關該反應的說法正確的是( )
Ti+2MgCl2 . 下列有關該反應的說法正確的是( )
A.TiCl4是還原劑
B.Mg被氧化
C.TiCl4發生氧化反應
D.Mg得到電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com