
以下是一些物質(zhì)的熔沸點數(shù)據(jù)(常壓):
| | 鉀 | 鈉 | Na2CO3 | 金剛石 | 石墨 |
| 熔點(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸點(℃) | 774 | 882.9 | 1850(分解產(chǎn)生CO2) | ---- | 4250 |
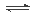 2 Na2CO3(l)+ C(s,金剛石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金剛石) △H=-1080.9kJ/mol
(1)0.0015 mol/(L ·min)(2分)
(2)增大壓強加快反應速率,反應向正反應方向移動(2分);
(3)3Na2O(s)+C(s,金剛石) = 4Na(g)+Na2CO3(l)△H= —4.2kJ/mol(2分);
(4)O2+2H2O+4e- =4OH-(2分);
(5)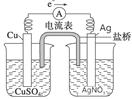 (2分)
(2分)
解析試題分析:(1)先根據(jù)定義式求v(Na),再根據(jù)速率之比等于化學方程式中的系數(shù)之比求v(CO2),即v(Na) =0.0020mol/(L?min), v(CO2)="3" v(Na)/4=0.0015mol/(L?min);(2)增大壓強加快反應速率,反應向正反應方向移動;(3)將已知兩個熱化學方程式編號為①②,①—②×3可以約去3 CO2(g),根據(jù)蓋斯定律,則6Na2O(s)+2C(s,金剛石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系數(shù)減半,則焓變也減半,則3Na2O(s)+ C(s,金剛石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(4)若K接M,則該裝置為原電池,模擬鋁的吸氧腐蝕,由于鋁比石墨活潑,則鋁是負極,石墨是正極,負極反應式為Al—3e—=Al3+,正極反應式為O2+4e—+2H2O=4OH—;(5)驗證Cu2+、Ag+氧化性的強弱,可根據(jù)置換反應:
Cu+2Ag+=Cu2++2Ag來設計原電池,銅發(fā)生氧化反應,銀離子發(fā)生還原反應。所以銅作負極,銀作正極,硫酸銅和硝酸銀作電解質(zhì)溶液。
考點:考查化學反應速率、化學平衡、電化學等相關(guān)知識。


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:填空題
已知:H2A的A2-可表示S2-、SO42—、SO32—、SiO32—或CO32—。
(1)常溫下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有關(guān)微粒物質(zhì)的量變化如下圖(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。請根據(jù)圖示填空: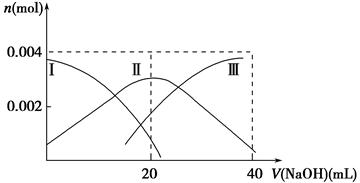
①當V(NaOH)=20 mL時,溶液中離子濃度大小關(guān)系:________。
②等體積等濃度的NaOH溶液與H2A溶液混合后,其溶液中水的電離程度比純水________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入_______________________________________________________。
(2)有關(guān)H2A的鈉鹽的熱化學方程式如下:
①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1 011.0 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
則反應③Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH3=________ kJ·mol-1。工業(yè)上制備Na2S時往往還要加入過量的碳,同時還要通入空氣,目的有兩個,其一是利用碳與氧氣反應放出的熱,維持反應③所需溫度;其二是________________________________________。
(3)若H2A為硫酸:t ℃時,pH=2的稀硫酸和pH=11的NaOH溶液等體積混合后溶液呈中性,則該溫度下水的離子積常數(shù)KW=________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
污染與環(huán)境保護已經(jīng)成為現(xiàn)在我國最熱門的一個課題,污染分為空氣污染,水污染,土壤污染等。
(1)為了減少空氣中SO2的排放,常采取的措施有:
①將煤轉(zhuǎn)化為清潔氣體燃料。
已知:H2(g)+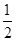 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+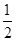 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
寫出焦炭與水蒸氣反應的熱化學方程式: 。
該反應的平衡常數(shù)表達式為K= 。
②洗滌含SO2的煙氣。以下物質(zhì)可作洗滌劑的是 (選填序號)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)為了減少空氣中的CO2,目前捕碳技術(shù)在降低溫室氣體排放中具有重要的作用,捕碳劑常用(NH4)2CO3,反應為:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3為研究溫度對(NH4)2CO3捕獲CO2效率的影響,在某溫度T1下,將一定量的(NH4)2CO3溶液置于密閉容器中,并充入一定量的CO2氣體(用氮氣作為稀釋劑),在t時刻,測得容器中CO2氣體的濃度。然后分別在溫度為T2、T3、T4、T5下,保持其他初始實驗條件不變,重復上述實驗,經(jīng)過相同時間測得CO2氣體濃度,其關(guān)系如圖,則: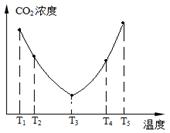
①ΔH3 0(填“>”、“=”或“<”)。
②在T4~T5這個溫度區(qū)間,容器內(nèi)CO2氣體濃度變化趨勢的原因是: 。
(3)催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
①催化反硝化法中,用H2將NO3-還原為N2,一段時間后,溶液的堿性明顯增強。則反應離子方程式為: 。
②電化學降解NO3-的原理如圖,電源正極為: (選填填“A”或“B”),陰極反應式為: 。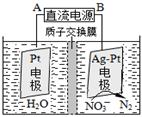
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
空氣質(zhì)量與我們的健康息息相關(guān),目前我國通過監(jiān)測6項污染物的質(zhì)量濃度來計算空氣質(zhì)量指數(shù)(AQI),SO2、NO2和CO是其中3項中的污染物。
(1)上述3種氣體直接排入空氣后會引起酸雨的氣體有 (填化學式)。
(2)早期人們曾經(jīng)使用鉛室法生產(chǎn)硫酸,其主要反應為:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
則SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定溫度下,向固定體積為2 L的密閉容器中充入SO2和NO2各1 mol,發(fā)生反應:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事實中不能說明該反應達到平衡狀態(tài)的是 (選填序號)。
SO3(g)+NO(g)。下列事實中不能說明該反應達到平衡狀態(tài)的是 (選填序號)。
a.體系壓強保持不變 b.混合氣體的顏色保持不變
c.NO的物質(zhì)的量保持不變 d.每生成1 mol SO3的同時消耗1 mol NO2
③測得②中反應5 min末到達平衡,此時容器中NO與NO2的體積比為3︰1,則這段時間內(nèi)SO2的反應速率υ(SO2)= ,此反應在該溫度下的平衡常數(shù)K= 。
(3)甲醇日趨成為重要的有機燃料,通常利用CO和H2合成甲醇,其反應的化學方程式為CO(g)+2H2(g) CH3OH(g)。今在一容積可變的密閉容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡轉(zhuǎn)化率(α)與溫度(T)、壓強(P)的關(guān)系如圖所示:
CH3OH(g)。今在一容積可變的密閉容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡轉(zhuǎn)化率(α)與溫度(T)、壓強(P)的關(guān)系如圖所示:
①上述合成甲醇的反應為 反應(填“放熱”或“吸熱”)。
②A、B、C三點的平衡常數(shù)KA、KB、KC的大小關(guān)系為 。
③若將達到平衡狀態(tài)A時生成的甲醇用于構(gòu)成甲醇一氧氣燃料電池,電解質(zhì)溶液為KOH濃溶液,則該電池工作時正極的電極反應式為 ,理論上通過外電路的電子最多為 mol。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源,由合成氣(組成為H2、CO、和少量CO2)直接制備二甲醚,其中主要過程包括以下四個反應(均為可逆反應):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤氣變換反應③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反應④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制備二甲醚(另一產(chǎn)物為水蒸氣)的熱化學方程式為 。
(2)一定溫度下,在恒容密閉容器中進行反應①,下列描述能說明反應到達平衡狀態(tài)的是 。
a.容器中氣體平均相對分子質(zhì)量保持不變
b.容器中氣體密度保持不變
c.CH3OH(g)濃度保持不變
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定溫度下,將8mol CH3OH(g)充入5L密閉容器中進行反應④,一段時間后到達平衡狀態(tài),反應過程中共放出49kJ熱量,則CH3OH(g)的平衡轉(zhuǎn)化率為 ,該溫度下,平衡常數(shù)K= ;該溫度下,向容器中再充入2mol CH3OH(g),對再次達到的平衡狀態(tài)的判斷正確的是 。
a.CH3OH(g)的平衡轉(zhuǎn)化率減小
b.CH3OCH3 (g)的體積分數(shù)增大
c.H2O(g)濃度為0.5mol·L-1
d.容器中的壓強變?yōu)樵瓉淼?.25倍
(4)二甲醚—氧氣燃料電池具有啟動快,效率高等優(yōu)點,其能量密度高于甲醇燃料電池,若電解質(zhì)為酸性,二甲醚—氧氣燃料電池的負極反應為 ;消耗2.8L(標準狀況)氧氣時,理論上流經(jīng)外電路的電子 mol
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源,由合成氣(組成為H2、CO、和少量CO2)直接制備二甲醚,其中主要過程包括以下四個反應(均為可逆反應):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤氣變換反應③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反應④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制備二甲醚(另一產(chǎn)物為水蒸氣)的熱化學方程式為 。
(2)一定溫度下,在恒容密閉容器中進行反應①,下列描述能說明反應到達平衡狀態(tài)的是 。
a.容器中氣體平均相對分子質(zhì)量保持不變
b.容器中氣體密度保持不變
c.CH3OH(g)濃度保持不變
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定溫度下,將8mol CH3OH(g)充入5L密閉容器中進行反應④,一段時間后到達平衡狀態(tài),反應過程中共放出49kJ熱量,則CH3OH(g)的平衡轉(zhuǎn)化率為 ,該溫度下,平衡常數(shù)K= ;該溫度下,向容器中再充入2mol CH3OH(g),對再次達到的平衡狀態(tài)的判斷正確的是 。
a.CH3OH(g)的平衡轉(zhuǎn)化率減小
b.CH3OCH3 (g)的體積分數(shù)增大
c.H2O(g)濃度為0.5mol·L-1
d.容器中的壓強變?yōu)樵瓉淼?.25倍
(4)二甲醚—氧氣燃料電池具有啟動快,效率高等優(yōu)點,其能量密度高于甲醇燃料電池,若電解質(zhì)為酸性,二甲醚—氧氣燃料電池的負極反應為 ;消耗2.8L(標準狀況)氧氣時,理論上流經(jīng)外電路的電子 mol
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氫氣是一種新型的綠色能源,又是一種重要的化工原料。
(1)氫氣燃燒熱值高。實驗測得,在常溫常壓下,1 g H2完全燃燒生成液態(tài)水,放出142.9 kJ熱量。則H2燃燒熱的化學方程式為 。
(2)氫氣是合成氨的重要原料,合成氨反應的熱化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①當合成氨反應達到平衡后,改變某一外界條件(不改變N2、H2和NH3的量),反應速率與時間的關(guān)系如下圖所示。圖中t1時引起平衡移動的條件可能是 其中表示平衡混合物中NH3的含量最高的一段時間是 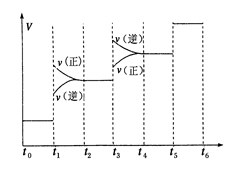
②溫度為T ℃時,將2 a mol H2和a mol N2放入0.5 L密閉容器中,充分反應后測得N2的轉(zhuǎn)化率為50%。則反應的平衡常數(shù)為
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是一種可再生能源,具有廣泛的開發(fā)和應用前景。
(1)工業(yè)上一般采用下列兩種反應合成甲醇:
反應Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反應Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列數(shù)據(jù)是反應Ⅰ在不同溫度下的化學平衡常數(shù)(K)。
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知:①溶液中CrO42—顯黃色,Cr2O72-顯橙紅色
②PbCrO4難溶于水,也難溶于強酸
③H+(aq)+OH-(aq)=H2O(l); ΔH=" —a" KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH="—b" KJ/mol
2CrO42-(aq)+2H+(aq)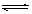 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
平衡常數(shù)K=9.5×104 (上述a、b、c均大于0)
對上述反應⑤,取50mL溶液進行試驗,部分測定數(shù)據(jù)如下:
| 時間(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com