
2012年8月24日,武漢市一家有色金屬制造廠發生氨氣泄露事故。已知在一定溫度下,合成氨工業原料氣H2制備涉及下面的兩個反應:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判斷反應CO(g)+H2O(g) CO2(g)+H2(g)達到化學平衡狀態的依據是________。(多選、漏選、錯選均不得分)
CO2(g)+H2(g)達到化學平衡狀態的依據是________。(多選、漏選、錯選均不得分)
A.容器內壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密閉容器中通入1 mol N2(g)和3 mol H2(g),發生反應:3H2(g)+N2(g)  2NH3(g),ΔH<0,測得壓強-時間圖像如圖甲,測得p2=0.6p1,此時溫度與起始溫度相同,在達到平衡前某一時刻(t1)若僅改變一種條件,得到如乙圖像。
2NH3(g),ΔH<0,測得壓強-時間圖像如圖甲,測得p2=0.6p1,此時溫度與起始溫度相同,在達到平衡前某一時刻(t1)若僅改變一種條件,得到如乙圖像。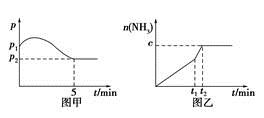
①若圖中c=1.6 mol,則改變的條件是________(填字母);
②若圖中c<1.6 mol,則改變的條件是__________(填字母);此時該反應的平衡常數____________。(填字母)(填“增大”、“減小”、“不變”)
A.升溫 B.降溫 C.加壓 D.減壓 E.加催化劑
(3)如(2)題中圖甲,平衡時氫氣的轉化率為________。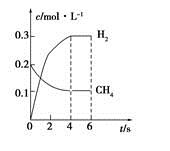
(4)工業上可利用如下反應:H2O (g)+CH4 (g)  CO(g)+3H2(g)制備CO和H2。在一定條件下1 L的密閉容器中充入0.3 mol H2O和0.2 mol CH4,測得H2(g)和CH4(g)的物質的量濃度隨時間變化曲線如右圖所示:0~4 s內,用CO(g)表示的反應速率為____________。
CO(g)+3H2(g)制備CO和H2。在一定條件下1 L的密閉容器中充入0.3 mol H2O和0.2 mol CH4,測得H2(g)和CH4(g)的物質的量濃度隨時間變化曲線如右圖所示:0~4 s內,用CO(g)表示的反應速率為____________。
科目:高中化學 來源: 題型:填空題
“潔凈煤技術”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續產出了高熱值的煤炭氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。生產煤炭氣的反應之一是:C(s)+H2O(g) CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。
(1)在容積為3L的密閉容器中發生上述反應,5min后容器內氣體的密度增大了0.12g/L,用H2O表示0~5miin的平均反應速率為_________________________。
(2)能說明該反應已達到平衡狀態的是________(選填編號)。
a.v正 (C)= v逆(H2O) b.容器中CO的體積分數保持不變
c.c(H2)=c(CO) d.炭的質量保持不變
(3)若上述反應在t0時刻達到平衡(如圖),在t1時刻改變某一條件,請在右圖中繼續畫出t1時刻之后正反應速率隨時間的變化: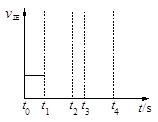
①縮小容器體積,t2時到達平衡(用實線表示);
②t3時平衡常數K值變大,t4到達平衡(用虛線表示)。
(4)在一定條件下用CO和H2經如下兩步反應制得甲酸甲酯:
①CO(g) + 2H2(g)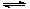 CH3OH(g) ②CO(g) + CH3OH(g)
CH3OH(g) ②CO(g) + CH3OH(g)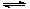 HCOOCH3(g)
HCOOCH3(g)
①反應①中CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。在不改變反應物用量的情況下,為提高CO的轉化率可采取的措施是 。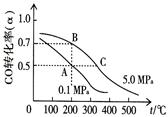
②已知反應①中CO的轉化率為80%,反應②中兩種反應物的轉化率均為85%,則5.04kgCO最多可制得甲酸甲酯 kg。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定溫度下,在1.0 L密閉容器中放入1 mol C(s)、1 mol H2O(g)進行反應,反應時間(t)與容器內氣體總壓強(p)的數據見下表:
| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 總壓強p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14 分)CO2和CH4是兩種重要的溫室氣體,通過CH4和CO2反應制造更高價值化學品是目前的研究目標。
(1)250℃時,以鎳合金為催化劑,向4 L密閉容器中通入6 mol CO2、6 mol CH4,發生如下反應:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡體系中各組分體積分數如下表:
2CO(g)+2H2(g)。平衡體系中各組分體積分數如下表:
| 物質 | CH4 | CO2 | CO | H2 |
| 體積分數 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ; (?代表CO的生成速率,■代表催化劑的催化效率)
(?代表CO的生成速率,■代表催化劑的催化效率)查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(16分)大氣中的部分碘源于O3對海水中I-的氧化。將O3持續通入NaI溶液中進行模擬研究。
(1)O3將I-氧化成I2的過程由3步反應組成:
①I-(aq)+ O3(g)==IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)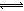 HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq)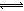 I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
總反應的化學方程式為______,其反應△H=______。
(2)在溶液中存在化學平衡:I2(aq)+I-(aq)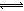 I3-(aq),其平衡常數表達式為_______。
I3-(aq),其平衡常數表達式為_______。
(3)為探究Fe2+對氧化I-反應的影響(反應體系如圖13),某研究小組測定兩組實驗中I3-濃度和體系pH,結果見圖14和下表。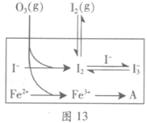
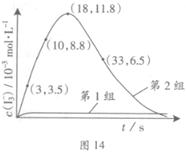
| 編號 | 反應物 | 反應前pH | 反應后pH |
| 第1組 | O3+ I- | 5.2 | 11.0 |
| 第2組 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
氮的固定有三種途徑:生物固氮、自然固氮和工業固氮。根據最新“人工固氮”的研究報道:在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生反應,生成的主要產物為NH3。進一步研究NH3生成量與溫度的關系,部分實驗數據見下表(光照、N2壓力1.0×105 Pa、反應時間1 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
 4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1 2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1 2NH3(g) ΔH=-92 .4 kJ·mol-1,分別研究在T1、T2和T3(T1<T2<T3)三種溫度下合成氨氣的規律。下圖是上述三種溫度下不同的H2和N2的起始組成比(起始時N2的物質的量均為1 mol)與N2平衡轉化率的關系。請回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分別研究在T1、T2和T3(T1<T2<T3)三種溫度下合成氨氣的規律。下圖是上述三種溫度下不同的H2和N2的起始組成比(起始時N2的物質的量均為1 mol)與N2平衡轉化率的關系。請回答: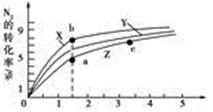
 N2(g)+3H2(g)的平衡常數為________ 。
N2(g)+3H2(g)的平衡常數為________ 。查看答案和解析>>
科目:高中化學 來源: 題型:問答題
利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟,已知
SO2(g)+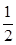 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某溫度下該反應的平衡常數K=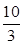 ,若在此溫度下,向100 L的恒容密閉容器中,充入3.0 mol
,若在此溫度下,向100 L的恒容密閉容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),則反應開始時v正 v逆(填“<”、“>”或“=”)。
(2)一定溫度下,向一帶活塞的體積為2 L的密閉容器中充入2.0 mol SO2和1.0 molO2,達到平衡后體積變為1.6 L,則SO2的平衡轉化率為 。
(3)在(2)中的反應達到平衡后,改變下列條件,能使SO2(g)平衡濃度比原來減小的是 (填字母)。
A保持溫度和容器體積不變,充入1.0 mol O2
B保持溫度和容器內壓強不變,充入1.0 mol SO3
C降低溫度
D移動活塞壓縮氣體
(4)若以右圖所示裝置,用電化學原理生產硫酸,寫出通入O2電極的電極反應式為 。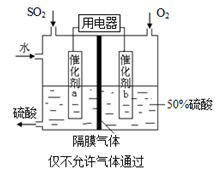
(5)為穩定持續生產,硫酸溶液的濃度應維持不變,則通入SO2和水的質量比為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
已知一氧化碳與水蒸氣的反應為:CO(g)+H2O (g) CO2(g)+H2(g) ,800℃時,在容積為2.0L的密閉容器中充入2.0mol CO(g)和3.0mol H2O(g),保持溫度不變,4 min后反應達到平衡,測得CO的轉化率為60%。
CO2(g)+H2(g) ,800℃時,在容積為2.0L的密閉容器中充入2.0mol CO(g)和3.0mol H2O(g),保持溫度不變,4 min后反應達到平衡,測得CO的轉化率為60%。
(1)求4 min內H2的平均化學反應速率。
(2)計算800℃時該反應的平衡常數。
(3)427℃時該反應的化學平衡常數為9.4,請結合(2)中的計算結果判斷該反應的ΔH 0(填“>”、“<”或“=” )。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(15分)乙醇是重要的有機化工原料,可由乙烯直接水合法或間接水合法生產。回答下列問題:
(1)間接水合法是指先將乙烯與濃硫酸反應生成硫酸氫乙酯(C2H5OSO3H)。再水解生成乙醇。寫出相應的反應的化學方程式
(2)已知:
甲醇脫水反應①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烴反應②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1KJ·mol-1
乙醇異構化反應③CH3CH2OH(g)=CH3OCH3(g))? △H3=+50.7KJ·mol-1
則乙烯氣相直接水合反應C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
與間接水合法相比,氣相直接水合法的優點是: 。
(3)下圖為氣相直接水合法中乙烯的平衡轉化率與溫度、壓強的關系(其中n(H2O)︰n(C2H4)=1︰1)
①列式計算乙烯水合制乙醇反應在圖中A點的平衡常數K= (用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
②圖中壓強P1、P2、P3、P4的大小順序為: ,理由是:
③氣相直接水合法黨采用的工藝條件為:磷酸/硅藻土為催化劑,反應溫度290 ℃,壓強6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的轉化率為5℅。若要進一步提高乙烯的轉化率,除了可以適當改變反應溫度和壓強外,還可以采取的措施有: 、 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com