
【題目】下列描述中正確的是( )
A. 氮原子的價電子排布圖:![]()
B. 2p和3p軌道形狀均為啞鈴形,能量也相等
C. 價電子排布為4s24p3的元素位于第四周期第ⅤA族,是p區元素
D. 鈉原子由1s22s22p63s1→1s22s22p63p1時,原子釋放能量,由基態轉化成激發態
【答案】C
【解析】
試題A.由洪特規則可知,電子優先占據1個軌道,且自旋方向相同;
B.3p軌道的能量大于2p軌道的能量;
C.價電子排布為4s24p3的元素有4個電子層、最外層電子數為5,最后填充p電子;
D.原子由基態變成激發態需要吸收能量.
解:A.根據“洪特規則”可知,2p軌道電子的自旋方向應該相同,正確的電子排布圖為:![]() ,故A錯誤;
,故A錯誤;
B.2p和3p軌道形狀均為啞鈴形,但是原子軌道離原子核越遠,能量越高,2p軌道能量低于3p,故B錯誤;
C.價電子排布為4s24p3的元素有4個電子層、最外層電子數為5,位于第四周期第ⅤA族,最后填充p電子,是p區元素,故C正確;
D.基態Na的電子排布式為1s22s22p63s1,由基態轉化成激發態1s22s22p63p1時,電子能量增大,需要吸收能量,故D錯誤;
故選C.


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源: 題型:
【題目】某一反應體系中有反應物和生成物共五種物質:O2、H2CrO4、Cr(OH)3、H2O、H2O2。 已知該反應中H2O2只發生如下過程:H2O2→O2
(1)該反應中的還原劑是______________。(填化學式)
(2)該反應中,發生還原反應的過程是________→________。(填化學式)
(3)寫出該反應的化學方程式,并用單線橋標出電子轉移的方向和數目:____________________________________________________________。
(4)如反應轉移了0.3 mol電子,則產生的氣體在標準狀況下體積為__________。
(5)反應8NH3+3Cl2=6NH4Cl+N2中,氧化劑與還原劑的物質的量之比是_________。
(6)KClO3可以和草酸(H2C2O4)、硫酸反應生成高效的消毒殺菌劑ClO2,還生成CO2和KHSO4等物質。寫出該反應的化學方程式:______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是
A. 1mol 鐵和高溫水蒸氣完全反應轉移的電子數為3NA
B. 常溫常壓下,1mol 氦氣含有的原子數為NA
C. 標準狀況下,11. 2 L 乙醇含有的分子數目為0. 5NA
D. 物質的量濃度為0.5 mol/L的MgCl2溶液中,含有Cl- 個數為 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八種離子中的若干種![]() 為確定甲溶液的組成,將其分成兩等份,進行如下實驗:
為確定甲溶液的組成,將其分成兩等份,進行如下實驗:
①向一份溶液中加入足量的NaOH濃溶液并加熱,產生的氣體在標準狀況下體積為4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以與溶液中的離子完全反應,過濾得66.3g沉淀及濾液。
③向上述沉淀中加入過量的鹽酸,產生的氣體通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述濾液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反應,據此,請回答下列問題![]() 用相應的離子符號表示
用相應的離子符號表示![]() :
:
⑴上述實驗③中得到沉淀X的質量為______;生成沉淀X的離子方程式為______.
⑵甲溶液中一定不存在的離子是______;可能存在的離子是______.
⑶甲溶液一定存在的離子中,物質的量最大的離子是______;物質的量最小的離子是______,此物質的量最小的離子其物質的量為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表代表周期表中的幾種短周期元素,下列說法中錯誤的是
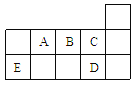
A. ED4分子中各原子均達8電子結構
B. AD3和ED4兩分子的中心原子均為sp3雜化
C. A、B、C第一電離能的大小順序為C>B>A
D. C、D氣態氫化物穩定性強弱和沸點高低均為C>D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】掌握儀器名稱、組裝及使用方法是中學化學實驗的基礎,下圖為兩套實驗裝置。


(1)寫出下列儀器的名稱:a._________,b.__________,c.___________。
(2)儀器a~e中,使用前必須檢查是否漏水的有_______________。(填序號)
(3)若利用裝置分離四氯化碳和酒精的混合物,還缺少的儀器是__________,將儀器補充完整后進行實驗,溫度計水銀球的位置在_______處。冷凝水由______口流出(填f或g)。
(4)現需配制0.1mol/LNaOH溶液450mL,裝置是某同學轉移溶液的示意圖。
①圖中的錯誤是________________。
②根據計算得知,需用托盤天平稱量的NaOH的質量為____g 。
(5)若出現如下情況,對所配溶液濃度將有何影響(填“偏高”、“偏低”或“無影響”)。若未等溶液冷卻就轉移至容量瓶并定容_________;容量瓶用蒸餾水洗滌后殘留有少量的水________;若定容時俯視刻度線_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關分散系的敘述中不正確的是( )
A.膠體分散質粒子較大,不能透過濾紙
B.分散系根據分散質粒子大小分為溶液、膠體和濁液三類
C.利用丁達爾效應可以區分溶液和膠體
D.將納米材料![]() 微粒直徑是1nm-100nm)分散到液體分散劑中的分散系屬于膠體
微粒直徑是1nm-100nm)分散到液體分散劑中的分散系屬于膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以柏林綠Fe[Fe(CN)6]為代表的新型可充電鈉離子電池,其放電工作原理如圖所示。下列說法正確的是

A. 放電時,Mo箔上的電勢比Mg箔上的低
B. 充電時,Mo箔接電源的負極
C. 放電時,正極反應為Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充電時,外電路中通過0.2mol電子時,陰極質量增加3.55g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國是世界上最大的鎢儲藏國,金屬鎢可用于制造燈絲、合金鋼和光學儀器,有“光明使者”的美譽,現以白鎢礦(主要成分為CaWO4,還含有二氧化硅、氧化鐵等雜質)為原料冶煉高純度金屬鎢,工業流程如圖:
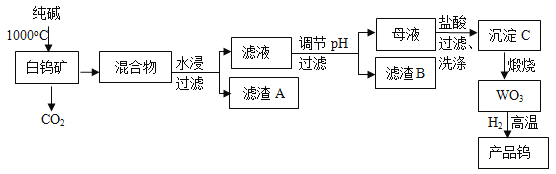
已知:①鎢酸酸性很弱,難溶于水;
②完全沉淀離子的pH值:SiO32﹣為8,WO42﹣為5;
③碳和金屬鎢在高溫下會反應生成碳化鎢。
回答下列問題:
(1)工業上生產純堿常先制得碳酸氫鈉,此法叫“聯堿法”,為我國化工專家侯德榜創立,即向飽和食鹽水中先通入NH3,再通入CO2,最終生成碳酸氫鈉晶體和氯化銨溶液,寫出該化學反應方程式:____。
(2)流程中白鎢礦CaWO4和純堿發生的化學反應方程式是:____。
(3)濾渣B的主要成分是(寫化學式)___。調節pH可選用的試劑是:__(填選項)。
A.氨水 B.鹽酸 C.NaOH溶液 D.Na2CO3溶液
(4)檢驗沉淀C已經洗滌干凈的操作是____。
(5)為了獲得可以拉制燈絲的高純度金屬鎢,不宜用碳而必須用氫氣作還原劑的原因是:___。
(6)將氫氧化鈣加入鎢酸鈉堿性溶液中可得到鎢酸鈣,已知某溫度時,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,當溶液中WO42﹣恰好沉淀完全(離子濃度等于10﹣5mol/L)時,溶液中c(OH﹣)=____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com