
【題目】FeCl3是重要的化工原料,無水氯化鐵在300℃時升華,極易潮解。
I.制備無水氯化鐵。
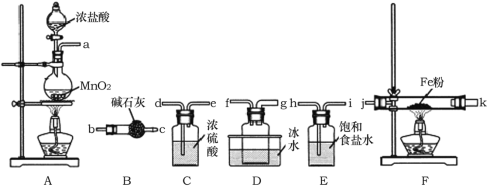
(1)A裝置中發生反應的離子方程式為______________。
(2)裝置的連接順序為a→______________→j,k→______________(按氣流方向,用小寫字母表示)。
(3)實驗結束后,取少量F裝置玻璃管中的固體加水溶解,經檢測,發現溶液中含有Fe2+,可能原因為______________。
II.探究FeCl3與SO2的反應。
(4)已知反應體系中存在下列兩種化學變化:
(i)Fe3+與SO2發生絡合反應生成Fe(SO2)63+(紅棕色);
(ii)Fe3+與SO2發生氧化還原反應,其離子方程式為______________。
(5)實驗步驟如下,并補充完整。
步驟 | 現象 | 結論 |
①取5mL1mol·L-1FeCl3溶液于試管中,通入SO2至飽和。 | 溶液很快由黃色變為紅棕色 | |
②用激光筆照射步驟①中的紅棕色液體。 | _______________ | 紅棕色液體不是Fe(OH)3膠體 |
③將步驟①中的溶液靜置。 | 1小時后,溶液逐漸變為淺綠色 | |
④向步驟③中溶液加入2滴___________ 溶液(填化學式)。 | _______________ | 溶液中含有Fe2+ |
(6)從上述實驗可知,反應(i)、(ii)的活化能大小關系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常數大小關系是:K(i)__________K(ii)。
【答案】MnO2+2Cl+4H+![]() Mn2++Cl2↑+2H2O h,i,d,e g,f,b,(c) 未升華出來的FeCl3與未反應完的鐵粉在水溶液中反應生成Fe2+ SO2+2H2O+2Fe3+===SO42-+4H++2Fe2+ 液體中無明顯光路 K3[Fe(CN)6] 生成藍色沉淀 ﹤ ﹤
Mn2++Cl2↑+2H2O h,i,d,e g,f,b,(c) 未升華出來的FeCl3與未反應完的鐵粉在水溶液中反應生成Fe2+ SO2+2H2O+2Fe3+===SO42-+4H++2Fe2+ 液體中無明顯光路 K3[Fe(CN)6] 生成藍色沉淀 ﹤ ﹤
【解析】
Ⅰ首先制取氯氣,然后除雜、干燥,再與鐵粉反應,冷凝法收集升華出的FeCl3,最后連接盛有堿石灰的干燥劑,吸收多余的氯氣,防止空氣中的水蒸氣使FeCl3水解。F中剩余的固體可能為未升華的FeCl3和鐵粉的混合物,溶于水發生反應生成FeCl2;
Ⅱ①Fe3+與SO2發生氧化還原反應生成Fe3+和SO42-,根據得失電子守恒、電荷守恒和原子守恒寫出離子方程式;
②沒有出現丁達爾現象,說明紅棕色物質不是Fe(OH)3膠體;
③用K3Fe(CN)6溶液檢驗Fe2+,生成藍色沉淀;
④反應(i)比反應(ii)快,則活化能E(i)<E(ii);反應(ii)進行的程度更大,則平衡常數K(i)<K(ii);
Ⅰ(1)反應的離子方程式為:MnO2+2Cl+4H+![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)首先制取氯氣,然后除雜、干燥,導管應長進短出,所以a連接h,i連接d;在F中與鐵粉反應,為防止FeCl3堵塞導管,應用粗導管,則e連接j,冷凝法收集升華出的FeCl3,所以k連接g;最后連接盛有堿石灰的干燥管,吸收未反應的氯氣;
(3)實驗結束后,去少量F中的固體加水溶解,經檢測發現溶液中含有Fe2+,其原因為未升華出來的FeCl3與未反應的Fe發生反應生成Fe2+;
Ⅱ(4)Fe3+與SO2發生氧化還原反應生成Fe3+和SO42-,根據得失電子守恒、電荷守恒和原子守恒,離子方程式為SO2+2H2O+2Fe3+===SO42-+4H++2Fe2+;
(5)沒有出現丁達爾現象,說明紅棕色物質不是Fe(OH)3膠體;
(6)由實驗現象可知,FeCl3與SO2首先發生反應(i),說明反應(i)比反應(ii)快,則活化能E(i)<E(ii);反應最終得到Fe2+,反應(ii)進行的程度更大,則平衡常數K(i)<K(ii)。


科目:高中化學 來源: 題型:
【題目】實驗室用氨氣還原氧化銅的方法測定銅的近似相對原子質量,反應的化學方程式為:2NH3+3CuO![]() N2+3Cu+3H2O,試回答:
N2+3Cu+3H2O,試回答:
(1)如果選用測定反應物CuO和生成物H2O的質量[m(CuO)、m(H2O)] 時,請用下圖所列儀器設計一個簡單的實驗方案。
(2)①請寫出用下圖裝置制備氨氣的化學反應方程式___________________。

②儀器連接的順序為(用字母編號表示,儀器可重復使用) ______________________,(d)中濃硫酸的作用是___________,實驗完畢時觀察到(a)中的現象是______________________。
③列出計算Cu的相對原子質量的表達式:______________________。
(2)有同學認為NH3與CuO反應生成的紅色物質中可能含有Cu2O。已知Cu2O是紅色粉末,在酸性溶液中,Cu+能自身發生氧化還原反應生成Cu2+和Cu。
①若CuO未完全分解,則所測定的Cu的相對原子質量會______________(偏大或偏小)。
②請設計一個簡單的實驗檢驗該紅色物質中是否含有Cu2O________________。
(3)在解決了問題(2)后,又有同學提出:Cu2O與CuO的熱穩定性哪個更強?于是他們進行了如下實驗:取0.98 g Cu(OH)2固體,加熱到80℃~100℃時,得到黑色固體粉末,繼續加熱到1000℃以上,黑色粉末全部變成紅色粉末B。如下圖所示:
據此可推得A為__________,且AB段發生的反應為_________________,
由此得到的熱穩定性的結論是____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家研發了一種室溫下“可呼吸”的Na—CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:3CO2+4Na![]() 2Na2CO3+C。下列說法錯誤的是
2Na2CO3+C。下列說法錯誤的是

A. 放電時,ClO4-向負極移動
B. 充電時釋放CO2,放電時吸收CO2
C. 放電時,正極反應為:3CO2+4e =2CO32-+C
D. 充電時,正極反應為:Na++e=Na
查看答案和解析>>
科目:高中化學 來源: 題型:
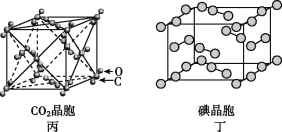
【題目】有關晶體的結構如圖所示,下列說法中不正確的是
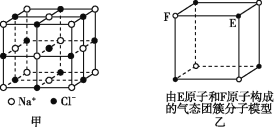
A. 在NaCl晶體(圖甲)中,距Na+最近的Cl-形成正八面體
B. 該氣態團簇分子(圖乙)的分子式為EF或FE
C. 在CO2晶體(圖丙)中,一個CO2分子周圍有12個CO2分子緊鄰
D. 在碘晶體(圖丁)中,存在非極性共價鍵和范德華力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.有下列物質:①鈉 ②金剛石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化銨 ⑦水晶 ⑧Cl2
(1)屬于原子晶體的是_________,屬于金屬晶體的是_________。
(2)既含有離子鍵又含有共價鍵的是_________。
(3)③熔化時克服作用力的有_________。
(4)Na2O2的電子式 ________________。
(5)②、③、⑤、⑦、⑧熔點由低到高的順序為________________。
II.在生產生活以及化學科學研究中,水都有重要的作用。
(1)與H2O分子是等電子體的微粒_________(陰離子及分子各寫一個)。
(2)水分子在特定條件下容易得到一個H+,形成水合氫離子(H3O+)。下列對上述過程的描述不合理的是__________。
A.微粒的形狀發生了改變
B.氧原子的雜化類型發生了改變
C.微粒中的鍵角發生了改變
D.微粒的化學性質發生了改變
(3)向CuSO4溶液中加入氨水,溶液變成深藍色,請寫出發生此變化的離子方程式______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
(1)CO還原NO的反應為2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)H=-746kJ·mol-1。
2CO2(g)+N2(g)H=-746kJ·mol-1。
寫出兩條有利于提高NO平衡轉化率的措施______________、______________。
(2)用焦炭還原NO的反應為:2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
H。恒容恒溫條件下,向體積相同的甲、乙、丙三個容器中分別加入足量的焦炭和一定量的NO,測得各容器中NO的物質的量[n(NO)]隨反應時間(t)的變化情況如表所示:
t/min n(NO)/mol 容器 | 0 | 40 | 80 | 120 | 160 |
甲/400℃ | 2.00 | 1.5 | 1.10 | 0.80 | 0.80 |
乙/400℃ | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙/T℃ | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①H______________0(填“>”或“<”);
②乙容器在160min時,v正_________v逆(填“>”、“<”或“=”)。
(3)某溫度下,向體積為2L的恒容真空容器中通入2.0molNO2,發生反應:2NO2(g)![]() N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2為速率常數。測得NO2的體積分數[x(NO2)]與反應時間(t)的關系如表:
N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2為速率常數。測得NO2的體積分數[x(NO2)]與反應時間(t)的關系如表:
t/min | 0 | 20 | 40 | 60 | 80 |
x(NO2) | 1.0 | 0.75 | 0.52 | 0.50 | 0.50 |
①![]() 的數值為______________;
的數值為______________;
②已知速率常數k隨溫度升高而增大,則升高溫度后k1增大的倍數___________k2增大的倍數(填“>”、“<”或“=”)。
(4)用間接電化學法除去NO的過程,如圖所示:
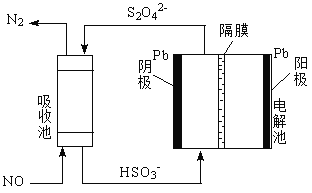
①已知電解池的陰極室中溶液的pH在4~7之間,寫出陰極的電極反應式:______________;
②用離子方程式表示吸收池中除去NO的原理:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在800℃2L密閉容器中,反應2NO+O2![]() 2NO2,n(NO)隨時間的變化如下表:
2NO2,n(NO)隨時間的變化如下表:
時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如圖表示各物質濃度的變化曲線。

A點處,v(正)__v(逆),A點正反應速率__B點正反應速率。(用“>”、“<”、“=”填空)
(2)圖中表示O2變化的曲線是__。用NO2表示從0~2s內該反應的平均速率v=__。
(3)能使該反應的反應速率增大的是__。
A.及時分離出NO2氣體 B.升高溫度
C.減小O2的濃度 D.選擇高效的催化劑
(4)能說明該反應已經達到平衡狀態的是__。
A.容器內壓強保持不變 B.v(NO)=2v(O2)
C.容器內的密度保持不變 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化學 來源: 題型:
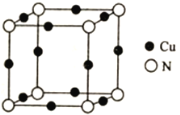
【題目】銅的相關化合物在化工、材料等領域有著廣泛的應用。回答下列問題:
(1)基態Cu原子中,核外電子占據的最高能層的符號是___________,占據該能層電子的電子云輪廓圖形狀為__________;Cu2+價層電子的電子排布圖為___________。
(2)離子晶體中Cu2O熔點比Cu2S熔點高,其原因是___________________________。
(3)Cu可與N、S,O等元素形成化合物,N、S、O三種元素的第一電離能由大到小的順序為______________;在Cu的催化作用下,乙醇可被氧化為乙醛,乙醛分子中碳原子的雜化方式是________________。
(4)1mo[Cu(NH3)4]SO4中含有σ鍵的數目為___________。
(5)Cu與N所形成的某種晶體的立方晶胞如圖所示,其晶胞參數為anm。該晶體的化學式為___________,晶體的密度為___________g·cm-3(列出計算式即可,用NA表示阿伏加德羅常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.乙烯、聚乙烯、乙炔、聚乙炔都能使溴水或高錳酸鉀溶液褪色,但與兩種試劑發生反應的反應類型是不同的
B.最簡單的芳香族化合物是苯,最簡單的糖是葡萄糖
C.常溫下苯與液溴、鐵粉混合反應生成的油狀有機物呈紅褐色,這是溶有氫氧化鐵雜質造成的
D.三氯異氰尿酸(TCCA)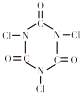 是用于游泳池等公共場合消毒的第三代產品,具有強烈的氯氣刺激味,含有效氯在90%以上,結構簡式如圖所示.據此推測TCCA分子中氯元素顯正價
是用于游泳池等公共場合消毒的第三代產品,具有強烈的氯氣刺激味,含有效氯在90%以上,結構簡式如圖所示.據此推測TCCA分子中氯元素顯正價
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com