
化學學科中的化學平衡、電離平衡、水解平衡和溶解平衡均符合勒夏特列原理。
請回答下列問題: (1)工業上采取CO和H2為原料合成乙醇,其化學反應方程式為:2CO(g)+4H2(g)??
(1)工業上采取CO和H2為原料合成乙醇,其化學反應方程式為:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。請寫出該反應的化學平衡常數表達式K=________。
(2)常溫下,濃度均為0.1 mol·L-1的六種溶液的pH如下表:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |

科目:高中化學 來源: 題型:填空題
向2 L密閉容器中通入a mol氣體A和b mol氣體B,在一定條件下發生反應:xA(g)+yB(g) pC(g)+qD(g)已知:平均反應速率v(C)=
pC(g)+qD(g)已知:平均反應速率v(C)= v(A),反應2 min時,A的濃度減少了
v(A),反應2 min時,A的濃度減少了 ,B的物質的量減少了
,B的物質的量減少了 mol,有a mol D生成,回答下列問題:
mol,有a mol D生成,回答下列問題:
(1)反應2 min內v(A)=________,v(B)=________
(2)化學方程式中,x=__________,y=__________,p=________,q=________
(3)反應平衡時,D為2a mol,則B的轉化率為________。
(4)如果只升高反應溫度,其他反應條件不變,平衡時D為1.5a mol,則該反應的ΔH________0(填“>”“<”或“=”)
(5)如果其他條件不變,將容器的容積變為1 L,進行同樣的實驗,則與上述反應比較:
①反應速率________(填“增大”、“減小”或“不變”),理由是________。
②平衡時反應物的轉化率________(填“增大”“減小”或“不變”),理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
298 K時,某容積固定為1 L的密閉容器中發生如下可逆反應:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物質的量濃度隨時間變化如圖所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物質的量濃度隨時間變化如圖所示。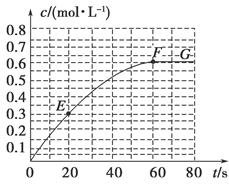
試回答下列問題。
(1)已知298 K時60 s達到平衡,比較40~60 s內和60~80s內B的平均反應速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K達到平衡時,B的平衡濃度為A的3倍,共放出熱量x kJ,開始加入A的物質的量是 mol。
(3)298k時,該反應的平衡常數為 mol/L。
(4)若反應在298 K進行,在1 L密閉容器中加入1 mol B、0.2 mol Ne,達到平衡時共吸收熱量y kJ,此時B的轉化率為 (填序號)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之間
(5)結合(2)、(4)相關數據,寫出a、x、y三者的等式關系式: 。
(6)若反應在298K進行,反應起始濃度為c(A)=c(B)=1.0mol/L,則化學平衡將 (填“正向”“逆向”或“不”)移動。
(7)已知曲線上任意兩點之間連線的斜率表示該時間段內B的平均反應速率(例如直線EF的斜率表示20 s~60 s內B的平均反應速率),則曲線上任意一點的切線斜率的意義是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義。
硫酸生產中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態)。根據圖示回答下列問題:
2SO3(g),混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態)。根據圖示回答下列問題:
(1)2SO2(g)+O2(g)  2SO3(g)的ΔH________0(填“>”或“<”);若在恒溫;恒壓條件下向上述平衡體系中通入氦氣,平衡________移動(填“向左”“向右”或“不”);
2SO3(g)的ΔH________0(填“>”或“<”);若在恒溫;恒壓條件下向上述平衡體系中通入氦氣,平衡________移動(填“向左”“向右”或“不”);
(2)若溫度為T1、T2,反應的平衡常數分別為K1,K2,則K1________K2;若反應進行到狀態D時,v正________v逆(填“>”“<”或“=”);
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
光氣(COCl2)在塑料、制革、制藥等工業中有許多用途,工業上采用高溫下CO與Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反應體系達到平衡后,各物質的濃度在不同條件下的變化狀況如下圖所示(第10 min到14 min的COCl2濃度變化曲線未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反應體系達到平衡后,各物質的濃度在不同條件下的變化狀況如下圖所示(第10 min到14 min的COCl2濃度變化曲線未示出):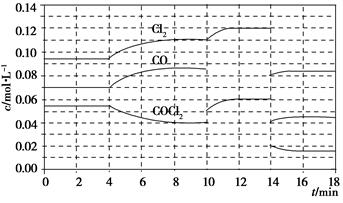
(1)化學平衡常數表達式K=________,計算反應在第8 min時的平衡常數K=________;
(2)比較第2 min反應溫度T(2)與第8 min反應溫度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min時反應于溫度T(8)下重新達到平衡,則此時c(COCl2)=________;10~12 min內CO的平均反應速率為v(CO)=________;
(4)比較產物CO在2~3min、5~6min和12~13min時平均反應速率(平均反應速率分別以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
合成氨尿素工業生產過程中涉及的物質轉化過程如下圖所示。
(1)天然氣在高溫、催化劑作用下與水蒸氣反應生成H2和CO的化學方程式為___________________________________。
(2)在合成氨生產中,將生成的氨氣及時從反應后的氣體中分離出來。運用化學平衡的知識分析這樣做是否有利于氨的合成,說明理由:___________。
(3)下圖為合成氨反應在不同溫度和壓強、使用相同催化劑條件下,初始時氮氣、氫氣的體積比為1:3時,平衡混合物中氨的體積分數。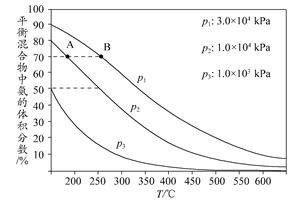
①若分別用vA(NH3)和vB(NH3)表示從反應開始至平衡狀態A、B時的化學反應速率,則vA(NH3)________vB(NH3)(填“>”、“<”或“=”)。
②在相同溫度下,當壓強由p1變為p3時,合成氨反應的化學平衡常數________(填“變大”、“變小”或“不變”)。
③在250°C、1.0×104kPa下,H2的轉化率為________%(計算結果保留小數點后1位)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
反應A+3B=2C+2D在四種不同情況下的反應速率可分別為
①v
| A.=0.15 mol/(L·s) ②v | B.=0.6 mol/(L·s) ③v | C.=0.4 mol/(L·s) ④v | D.=0.45 mol/(L·s) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)?2SO3(g)(△H<0)
(1)寫出該反應的化學平衡常數表達式K=
(2)降低溫度,該反應K值 ,二氧化硫轉化率 ,化學反應速率 (以上均填增大、減小或不變)。
(3)600℃時,在一密閉容器中,將二氧化硫和氧氣混合,反應過程中SO2、O2、SO3物質的量變化如圖,反應處于平衡狀態的時間是 。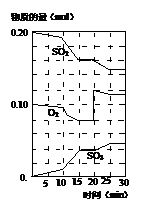
(4)據圖判斷,反應進行至20min時,曲線發生變化的原因是 (用文字表達)。
(5)10min到15min的曲線變化的原因可能是 (填寫編號)。
a.加了催化劑 b.縮小容器體積
c.降低溫度 d.增加SO3的物質的量。
(6)能說明該反應已經達到平衡狀態的是( )
a. v(SO3)=2v(O2) b.容器內壓強保持不變
c.v逆(SO2)=2v正(O2) d.恒容容器內物質的密度保持不變
(7)為使該反應的反應速率增大,且平衡向正反應方向移動的是( )
a.及時分離出SO3氣體 b.適當升高溫度
c.增大O2的濃度 d.選擇高效的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上生產硫酸的流程圖如下: 
請回答下列問題:
(1)早期生產硫酸以黃鐵礦為原料,但現在工廠生產硫酸以硫黃為原料,理由是 。
(2)在氣體進入催化反應室前需凈化的原因是 。
(3)在催化反應室中通常使用常壓,在此條件下SO2的轉化率為90%。但是部分發達國家采取高壓條件下制取SO3,采取加壓措施的目的除了加快反應速率外,還可以 ,從而提高生產效率 。
(4)工業生產中常用氨-酸法進行尾氣脫硫,以達到消除污染,廢物利用的目的。用化學方程式表示其反應原理: 。
(5)除硫酸工業外,還有許多工業生產。下列相關的工業生產流程中正確的是 。 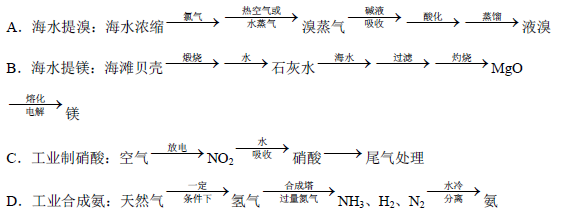
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com