
【題目】早在2000多年前,人們發現柳樹皮中含有一種具有解熱鎮痛功效的物質—水楊酸,此后科學家對水楊酸的結構進行一系列改造,合成出療效更佳的長效緩釋阿司匹林,其開發過程蘊含著重要的思想方法,請回答下列問題:
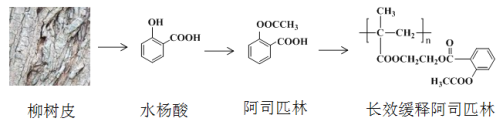
(1)水楊酸的結構與性質
①水楊酸中含氧官能團的名稱是____________、______________。
②下列關于水楊酸的說法正確的是__________。
A.分子式為C7H7O3
B.1 mol水楊酸能與2 molNaOH反應
C.可發生加成、取代、消去反應
(2)水楊酸的合成
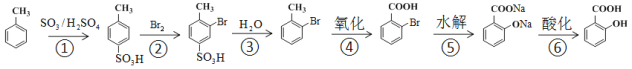
①由![]() 制
制![]() ,不采取甲苯直接與Br2直接反應,而是經過步驟①~③,目的是_______________
,不采取甲苯直接與Br2直接反應,而是經過步驟①~③,目的是_______________
②步驟④~⑥的順序能夠改為水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水楊酸具有解熱鎮痛的功效,但是其酸性很強,對人的腸胃有刺激性,容易引發胃潰瘍,1897年德國化學家菲利克斯·霍夫曼對水楊酸的結構進行改造合成出阿司匹林。
①水楊酸的酸性主要來源于-COOH,將-OH轉化為-OOCCH3,可使-COOH的酸性大大降低。科學家的這一設計思路依據的原理是_________________________________________
②水楊酸到阿司匹林的反應類型是_________
(4)1982年拜爾公司將阿司匹林與聚甲基丙烯酸借助乙二醇嫁接起來,研制出長效緩釋阿司匹林,可減少每天吃藥次數,大大方便了人們對藥物的使用。
①長效緩釋阿司匹林在人體內釋放出阿司匹林的反應類型是______________
②寫出乙烯經2步合成乙二醇的化學方程式_______________________、________________
【答案】羥基 羧基 B 防止生成![]() 副產物 不能 酚羥基也容易被氧化 官能團之間的相互影響 取代反應 水解反應
副產物 不能 酚羥基也容易被氧化 官能團之間的相互影響 取代反應 水解反應 ![]()
![]()
【解析】
(1)①水楊酸的結構簡式為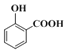 ,含有酚羥基和羧基二種官能團;
,含有酚羥基和羧基二種官能團;
②酚羥基和羧基均能和NaOH反應,能發生取代反應,苯環可發生加成反應;
(2)①有機反應副反應多,防止![]() 的生成;
的生成;
②酚羥基還原性強,易被氧化;
(3)①不同的官能團之間性質可能相互影響;
②由 可知酚羥基轉化為酯基;
可知酚羥基轉化為酯基;
(4)①長效緩釋阿司匹林的分子結構為 ,是高分子化合物,通過降解生成阿司匹林;
,是高分子化合物,通過降解生成阿司匹林;
②乙烯先與溴水發生加成,再在NaOH的溶液中水解即可生成乙二醇。
(1)①水楊酸的結構簡式為 ,含氧官能團的名稱是酚羥基、羧基;
,含氧官能團的名稱是酚羥基、羧基;
②A. 水楊酸的結構簡式為 ,其分子式為C7H6O3,故A錯誤;B. 酚羥基和羧基均能和NaOH反應,則1mol水楊酸能與2molNaOH反應,故B正確;C. 水楊酸的結構簡式為
,其分子式為C7H6O3,故A錯誤;B. 酚羥基和羧基均能和NaOH反應,則1mol水楊酸能與2molNaOH反應,故B正確;C. 水楊酸的結構簡式為 ,其中苯環可發生加成反應,酚羥基和羧基可發生取代反應,但此有機物不能發生消去反應,故C錯誤;故答案為B;
,其中苯環可發生加成反應,酚羥基和羧基可發生取代反應,但此有機物不能發生消去反應,故C錯誤;故答案為B;
(2)①![]() 在Fe粉催化作用下與Br2發生取代反應,除生成
在Fe粉催化作用下與Br2發生取代反應,除生成![]() 外,還有
外,還有![]() 副產物生成,則由
副產物生成,則由![]() 制
制![]() ,經過步驟①~③,不采取甲苯直接與Br2直接反應,可防止生成
,經過步驟①~③,不采取甲苯直接與Br2直接反應,可防止生成![]() 副產物;
副產物;
②因酚羥基易被氧化,如果先水解、再酸化、氧化,則將甲基氧化為羧基時,也能氧化酚羥基,故不能將步驟④~⑥的順序能夠改為水解、酸化、氧化;
(3)①因官能團之間的相互影響,因此將水楊酸分子內的-OH轉化為-OOCCH3,可能會使-COOH的酸性大大降低;
②由 可知水楊酸與乙酸發生酯化反應生成阿司匹林,其反應類型為取代反應;
可知水楊酸與乙酸發生酯化反應生成阿司匹林,其反應類型為取代反應;
(4)①長效緩釋阿司匹林的分子結構為 ,則長效緩釋阿司匹林在人體內釋放出阿司匹林的反應類型是水解反應;
,則長效緩釋阿司匹林在人體內釋放出阿司匹林的反應類型是水解反應;
②乙烯先與溴水發生加成,再在NaOH的溶液中水解即可生成乙二醇,則合成乙二醇涉及的化學方程式為![]() 、
、![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列有關化學反應的敘述正確的是( )
A.MnO2和稀鹽酸反應制取Cl2
B.過量氨水與SO2反應生成(NH4)2SO3
C.鐵在濃硝酸中發生鈍化
D.常溫下鈉與氧氣反應生成Na2O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于某有機物![]() 的性質敘述正確的是( )
的性質敘述正確的是( )
A. 1 mol該有機物可以與3 mol Na發生反應
B. 1 mol該有機物可以與3 mol NaOH發生反應
C. 1 mol該有機物可以與6 mol H2發生加成反應
D. 1 mol該有機物分別與足量Na或NaHCO3反應,產生的氣體在相同條件下體積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分子式為C12H14O2的有機物F廣泛用于制備香精的調香劑。為了合成該有機物,某實驗室的科技人員設計了下列合成路線。
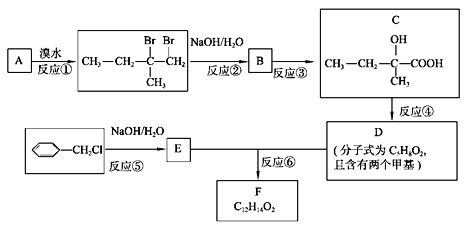
試回答下列問題:
(1) C物質中含有的官能團名稱是__________,________;A物質的名稱為_____________;
(2) 合成路線中反應③的反應類型為_________;
(3) 寫出E的結構簡式_________________,反應⑤的化學方程式為______________________;
(4) 按要求寫出E的一種同分異構體的結構簡式。要求:① 屬于芳香族化合物。② 遇濃溴水能產生白色沉淀。___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤的工業加工過程中,可利用CO和H2合成甲醇,能量變化如圖所示。下列說法正確的是
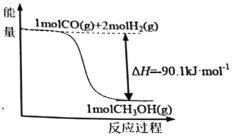
A.該反應是吸熱反應
B.1molCH3OH所具有的能量為90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2斷鍵所需能量小于1molCH3OH斷鍵所需能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水綜合利用要符合可持續發展的原則,其聯合工業體系(部分)如圖所示,下列說法不正確的是 ( )
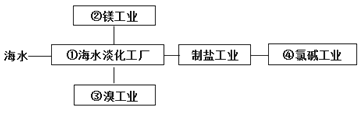
A.①中可采用蒸餾法
B.②中將MgCl2溶液蒸干即可得到無水MgCl2
C.③中提溴涉及到氧化還原反應
D.④的產品可生產鹽酸、漂白液等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某化學興趣小組為探究銅跟濃硫酸的反應,用如圖所示裝置進行有關實驗。

(1) 裝置A中發生反應的化學方程式為___________。
(2) 裝置D中試管口放置的棉花應浸一種溶液,這種溶液是______,其作用是___________。
(3) 裝置B的作用是貯存多余的氣體,當D處有明顯的現象后,關閉旋塞K,移去酒精燈, 但由于余熱的作用,A處仍有氣體產生,此時B中現象是____。
Ⅱ.乙酸乙酯廣泛用于藥物、染料、香料等工業,甲、乙兩同學分別設計如下裝置來 制備乙酸乙酯,已知:乙酸乙酯的沸點為77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
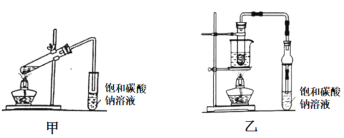
(1)甲裝置中右邊導管未插入溶液中的目的是 _________。
(2)實驗結束后分離出乙酸乙酯的操作是______,必須用到的玻璃儀器有_______(填序號)。
A. 燒杯 B. 容量瓶 C. 分液漏斗 D. 蒸餾燒瓶
(3)乙裝置優于甲裝置的理由________ (寫兩條)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈹銅是力學、化學綜合性能良好的合金,廣泛應用于制造高級彈性元件。以下是從某廢舊鈹銅元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收鈹和銅兩種金屬的流程

已知:I.鈹、鋁元素處于周期表中的對角線位置,化學性質相似
Ⅱ.常溫下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)濾液A的主要成分除NaOH外,還有______________ (填化學式)
寫出反應I中含鈹化合物與過量鹽酸反應的離子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,為提純BeCl2,選擇合理步驟并排序______________。
a加入過量的 NaOH b.通入過量的CO2 c加入過量的氨水
d.加入適量的HCl e.過濾 f洗滌
②從BeCl2溶液中得到BeCl2固體的操作是____________________________。
(3)①MnO2能將金屬硫化物中的硫元素氧化為單質硫,寫出反應Ⅱ中CuS發生反應的化學方程式________________________________________________________。
②若用濃HNO3溶解金屬硫化物,缺點是______________ (任寫一條)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水調節pH可依次分離,首先沉淀的是______________ (填離子符號),為使銅離子開始沉淀,常溫下應調節溶液的pH值大于______________。
(5)取鈹銅元件1000g,最終獲得Be的質量為81g,則產率是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】交聯聚合物P的結構片段如圖所示。下列說法不正確的是(圖中![]() 表示鏈延長)
表示鏈延長)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反應為縮聚反應
C. 聚合物P的原料之一丙三醇可由油脂水解獲得
D. 鄰苯二甲酸和乙二醇在聚合過程中也可形成類似聚合物P的交聯結構
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com