
【題目】下表標出的是元素周期表的一部分元素,回答下列問題:
A | B | C | |||||||||||||||
D | E | F | G | H | I | J | K | ||||||||||
M |
(1)除稀有氣體外第三周期中原子半徑最小的是_____(填元素符號)
(2)表中用字母標出的12種元素中,化學性質最不活潑的是_____(用元素符號表示,下同),金屬性最強的是___(用元素符號表示),屬于過渡元素的是___(該空格用表中的字母表示)
(3)以A的最簡單氫化物為燃料,D的最高價氧化物對應水化物為電解質溶液的燃料電池,其負極電極反應式為_____
(4)D、F元素最高價氧化物對應水化物相互反應的離子方程式為_____________
(5)為比較元素A和G的非金屬性強弱,用圖所示裝置進行實驗(夾持儀器已略去,裝置氣密性良好)。溶液B應該選用_____溶液,作用是_________,能說明A和G非金屬性強弱的化學方程式是:______________。
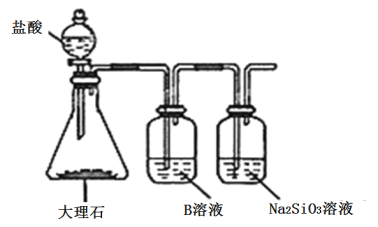
【答案】Cl Ar Na M CH4-8e-+10OH- =CO32-+7H2O Al(OH)3+OH﹣═AlO2﹣+2H2O 飽和NaHCO3 除去CO2中的HCl雜質 CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓
【解析】
根據元素周期表,A為C元素,B為O元素,C為F元素,D為Na元素,E為Mg元素,F為Al元素,G為Si元素,H為P元素,I為S元素,J為Cl元素,K為Ar元素,M為Mn元素,據此分析。
(1)第三周期中除稀有氣體元素外,原子半徑最小的為Cl元素;
(2)這12種元素中性質最不活潑的是Ar元素,金屬性最強的是Na元素,屬于過度金屬的是Mn元素;
(3)A的簡單氫化物為CH4,D的最高價氧化物對應水化物為NaOH,該原料電池的負極方程式為CH4-8e-+10OH-=CO32-+7H2O;
(4)D、F元素最高價氧化物對應水化物分別為NaOH和Al(OH)3,則二者發生反應的離子方程式為Al(OH)3+OH-=AlO2-+2H2O;
(5)為比較元素A和G的非金屬性強弱,溶液B應該選用飽和NaHCO3溶液,作用是除去CO2中的HCl雜質,能說明A和G非金屬性強弱的化學方程式是CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓。


 學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案
學期復習一本通學習總動員期末加暑假延邊人民出版社系列答案 芒果教輔暑假天地重慶出版社系列答案
芒果教輔暑假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】(1)在2L的密閉容器中放入4molN2O5,發生如下反應:2N2O5(g)![]() 4NO2(g)+O2(g)。反應至5min時,測得N2O5轉化了20%,則v(NO2)為___,c(N2O5)為___,O2的物質的量濃度為___。
4NO2(g)+O2(g)。反應至5min時,測得N2O5轉化了20%,則v(NO2)為___,c(N2O5)為___,O2的物質的量濃度為___。
(2)某溫度時,在一個2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示。根據圖中數據填空:

①該反應的化學方程式為___。
②反應至平衡時,v(X)為___,c(Z)為___。
③若X、Y、Z均為氣體,則達平衡時,容器內混合氣體的平均相對分子質量比起始投料時___(填“增大”“減小”或“相等”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,用元素符號或化學式填空回答以下問題:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
⑴在這些元素中,最活潑的非金屬元素是___________,化學性質最不活潑的元素是______________。
⑵表中金屬性最強的元素是_______________,其原子結構示意圖為 _______________________ 。
⑶表中元素的最高價氧化物對應的水化物中酸性最強的是__________,呈兩性的氫氧化物是______。
⑷元素⑩的元素符號為 ____________ ,元素⑦的原序數為_________。
⑸在①~③元素中,原子半徑最大的是_____________,原子半徑最小的是_____________。
⑹十種元素中有一種元素的氫化物水溶液呈堿性,該氫化物的電子式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋中有豐富的食品、礦產、能源、藥物和水產資源,下圖為海水利用的部分過程。
下列有關說法正確的是
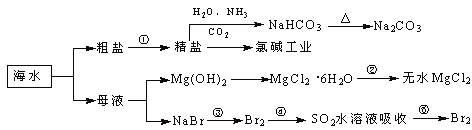
A. 過程①中除去粗鹽中的SO42-、Ca2+、Mg2+、Fe3+等雜質,加入的藥品順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸
B. 用澄清的石灰水可鑒別NaHCO3和Na2CO3
C. 過程②中結晶出的MgCl2·6H2O要在HCl氛圍中加熱脫水制得無水MgCl2
D. 工業上通過電解飽和MgCl2溶液制取金屬鎂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于Fe3+、Fe2+性質實驗的說法錯誤的是

A. 用上圖裝置可以制備沉淀Fe(OH)2
B. 配制FeCl3溶液時,先將氯化鐵晶體溶于較濃的鹽酸中,再加水稀釋到所需要的濃度
C. FeCl3溶液中滴加KSCN溶液會生成紅色沉淀
D. 向FeCl2溶液中加入少量鐵粉是為了防止Fe2+被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨硼烷(NH3·BH3)電池可在常溫下工作,裝置如圖所示。未加入氨硼烷之前,兩極室質量相等,電池反應為NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列說法正確的是( )

A. 正極的電極反應式為2H++2e-===H2↑
B. 電池工作時,H+通過質子交換膜向負極移動
C. 電池工作時,正、負極分別放出H2和NH3
D. 工作足夠長時間后,若左右兩極室質量差為1.9 g,則電路中轉移0.6 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列各組物質中:A.O2和O3 B.12C和13C C.H2O和D2O
___組兩物質互為同位素;___組兩物質互為同素異形體。
(2)工業上用![]() 做原料制取硝酸,要經過三步主要反應,請寫出第二步和第三步反應的化學方程式。
做原料制取硝酸,要經過三步主要反應,請寫出第二步和第三步反應的化學方程式。
第一步反應:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
第二步反應:___;
第三步反應:___。
(3)把下列現象中硫酸所表現出來的性質填寫在空白處。
用稀硫酸清洗鐵銹___;
放置在敞口燒杯中的濃硫酸質量增加__;
濃硫酸滴在紙上時,紙變黑。__;
把銅片放入熱的濃硫酸中時,有氣體放出。___。
(4)用序號填空,下列物質中:①PH3 ②H2O2 ③Na2O2 ④KOH ⑤(NH4)2SO4 ⑥F2
只含共價鍵的是___;既含離子鍵又含極性鍵的是___;既含離子鍵又含非極性鍵的是___。
(5)下列反應中,屬于放熱反應的有___(填序號)。
①煅燒石灰石(主要成分是CaCO3)制生石灰(CaO)
②Ba(OH)2·8H2O和NH4Cl晶體的反應
③炸藥爆炸
④酸與堿的中和反應
⑤生石灰與水作用制熟石灰
⑥食物因氧化而腐敗
⑦乙醇燃燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學在日常生活中用途廣泛,圖甲是原電池,電池總反應為Mg+ClO-+H2O=Cl-+ Mg(OH)2,圖乙是電解池,用于含Cr2O72-的工業廢水的處理。下列說法錯誤的是
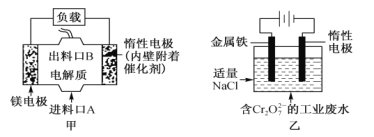
A. 圖甲中發生的氧化反應是Mg—2e-=Mg2+
B. 圖乙中惰性電極作電解池的陰極,電極棒上有H2放出
C. 圖乙中Cr2O72-向惰性電極移動,該極附近有Cr(OH)3生成
D. 若圖甲作為圖乙的電源,當消耗3.6g鎂時,理論上也消耗8.4g鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為某加碘鹽標簽的一部分。

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(無色)
某同學想定量測定此加碘鹽中碘元素的含量,進行以下實驗:
步驟1:稱取ag市售食鹽,配成溶液,全部轉移至錐形瓶中,加入適量新制KI溶液,滴入幾滴稀硫酸,溶液變黃色,再加入3滴淀粉溶液。
步驟2:取一支50mL堿式滴定管,用bmol·L-1的新制Na2S2O3 溶液潤洗2~3次后,裝滿溶液,調節液面高度至0刻度。
步驟3:開始滴定直至終點,重復操作2~3次,實驗數據記錄如下:

(1)第一次讀數為 mL。
(2)滴定終點的判斷方法 。
(3)經過計算,此碘鹽碘元素的含量為 mg·kg-1(用含a、b的最簡表達式表示) 。
(4)下列操作可能會導致測量結果偏低的是 。
A.步驟1中稱取食鹽時將砝碼放在左盤,食鹽放在放在右盤,游碼讀數為0.5g
B.步驟1所配食鹽溶液未完全轉移至錐形瓶
C.步驟2中滴定管洗滌后未潤洗
D.步驟3滴定前滴定管尖嘴處有氣泡,滴定后氣泡消失
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com